南佛罗里达大学蔡健峰团队PNAS:β−Catenin/BCL9蛋白质-蛋白质相互作用的拟肽抑制剂
在药物化学领域,拟肽螺旋折叠体在化学生物学和药物开发中的应用引起了人们的极大兴趣。螺旋折叠体具有许多的优点,如增强了对蛋白水解降解的抵抗力以及具有高的序列多样性,并被广泛应用于抑制蛋白质与蛋白质的相互作用。然而,细胞内蛋白的靶向性仍然面临着巨大的挑战,这在很大程度上是由于拟肽分子框架的可用性有限。作为一类新的蛋白水解稳定肽,γ-AApeptides是由南佛罗里达大学化学系蔡健峰团队近年来独立开发,并且已在化学生物学和生物医学科学领域开始扮演重要角色。特别是sulfono-γ-AApeptide,其一系列单晶结构显示其通过氢键作用而形成清晰的左旋螺旋结构(图1),被证明具有良好的折叠稳定性。作者设想,螺旋的sulfono-γ-AApeptides可能可以被用来开发一种新的拟肽试剂来破坏α-螺旋介导的蛋白质-蛋白质相互作用(PPI)。
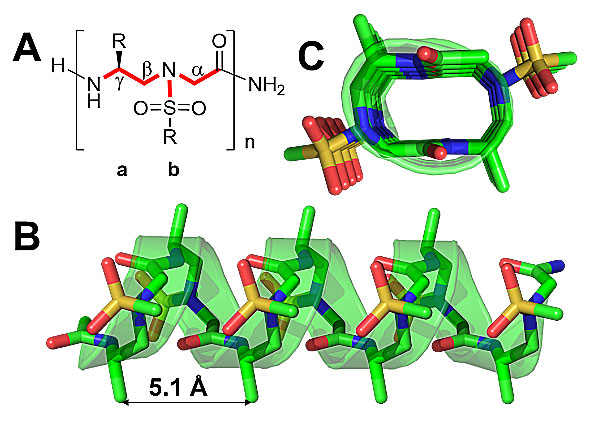
图 1. (A) Sulfono-γ-AApeptides的化学结构; a和b 分别表示building block 的手性侧链和sulfonamido 侧链; (B) Sulfono-γ-AApeptide的晶体结构; C. B的俯视图。
为了证明这个设想,蔡健峰(点击查看介绍)团队和Moffitt癌症中心的季海涛教授(点击查看介绍)团队合作,他们想知道B细胞淋巴瘤9(BCL9)(BCL9的α-螺旋HD2结构域可直接与β-catenin的表面凹槽相互作用)是否可以用来开发基于sulfono-γ-AApeptides拟肽的螺旋折叠体(图2)。Wnt/β-catenin信号通路在胚胎发育和组织内稳态以及几种类型的人类癌症,如结肠癌、乳腺癌、黑色素瘤、前列腺癌等中扮演重要的角色。作为信号的中心中介,β-catenin通过控制几个关键基因的表达来调控细胞周期和细胞凋亡。事实上,Wnt/β-catenin 信号通路的转录激活依赖于涉及到BCL9 或者BCL9-like(B9L)的β-catenin超复体的形成以及转录因子的T细胞因子(Tcf)/淋巴细胞增强结合因子(Lef)家族。特别地,BCL9作为Wnt增强体的骨架结构将β-catenin 带到TCF/LEF特定Wnt靶基因转录,从而引起细胞生长、增殖和分化。从这一点上来说,分子通过破坏BCL9/β-catenin蛋白质相互作用可以抑制Wnt/β-catenin信号转导,从而可以开发新型抗癌药物。
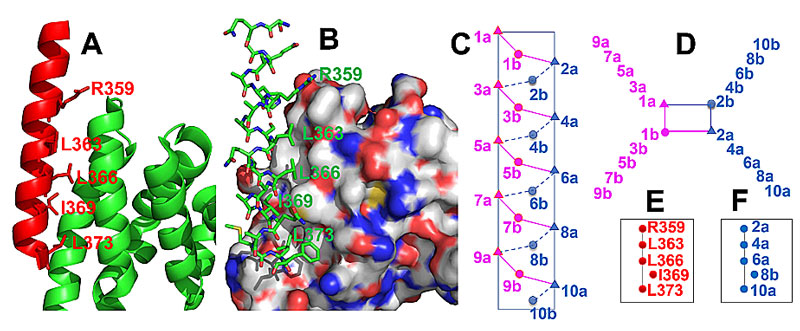
图 2. A-B. BCL9的α-螺旋HD2结构域(其直接接合β-catenin的表面凹槽)提供用于以烃装订安定结构的模板 [Protein Data Bank (PDB) ID code 2GL7]。(A) BCL9 的残基 (红色, 显示为棍状) 与 β-catenin作用界面的卡通图。 (B) BCL9 显示为棍状, β-catenin用曲面模型显示。(C–F) sulfono-γ-AApeptides的侧链分布示意图。 (C) 侧视图。 (D) 俯视图。 (E) BCL9螺旋的关键残基位置图。 (F) 设计用来模拟E 的sulfono-γ-AApeptides 的侧链位置图。
β-catenin/BCL9/TCF-4三元配合物的晶体结构显示BCL9的α-螺旋区域与β-catenin的绑定口袋相互作用(图2A和图2B)。BCL9的关键残基R359、L363、L366、I369和L373位于BCL9螺旋结构的同一面,形成亲水和疏水接触绑定β-catenin表面。尽管其作用机制明确,设计有效的能进入细胞内的抑制剂来阻断其蛋白质-蛋白质相互作用仍然是一个挑战。这主要归因于BCL9和β-catenin之间的相互作用是一个大约带有25个残基的BCL9螺旋段。虽然有报道采用小分子和肽抑制剂来破坏β-catenin/BCL9蛋白质-蛋白质相互作用,非天然拟肽抑制剂的例子很几乎没有。
作者设想非天然的模拟肽可能可以用来抑制β-catenin/BCL9蛋白质-蛋白质相互作用。与天然的BCL9相比,模拟肽具有高度的抗蛋白水解降解能力。这可能是由于已知的缩氨酸折叠体不能有效地模拟长的α-螺旋结构,以及可用的拟肽分子框架有限。作者设计了一系列sulfono-γ-AApeptides来模拟BCL9的螺旋结构(图2和3),希望可以用来破坏β-catenin/BCL9 蛋白质-蛋白质相互作用。如果能够成功,这将为发展有效的螺旋肽药物提供一个新的模板。

图3. (A) 棍状表示6的关键基团2a, 4a, 6a, 8b和10a; (B) 6 与BCL9关键基团的叠合; (C) 6的关键基团在β-catenin (PDB: 2GL7) 结合面上与BCL9 的叠合。
作者在此报道了一系列非天然螺旋的sulfono-γ-AApeptides来模拟天然的α-螺旋结构,从而抑制蛋白质-蛋白质相互作用。这些非天然的螺旋拟肽能够有效的以及专一性的抑制癌症相关的β-catenin / BCL9蛋白质-蛋白质相互作用。细胞研究表明,sulfono-γ-AApeptides 具有细胞渗透性,能有效抑制癌细胞的生长并激活Wnt/β-catenin信号。TOPFlash/FOPFlash荧光素酶报告分析表明sulfono-γ-AApeptides可以选择性地抑制Wnt/β-catenin蛋白信号的反式激活。蛋白质pull-down实验和co-IP实验表明这些sulfono-γ-AApeptides可以通过结合β-catenin在细胞中抑制β-catenin/BCL9蛋白质-蛋白质相互作用。β-catenin长期以来被认为是一个具有挑战性的靶点,这项工作也代表了非天然的拟肽在抑制catenin/BCL9蛋白质-蛋白质相互作用上的成功应用,为开发新的具有酶稳定性和细胞渗透性的折叠体拟肽抑制剂提供了一种实用方法。这项工作拓展了sulfono-γ-AApeptides在制备有效的、细胞渗透性的拟肽试剂上的应用,从而为其在化学生物学和生物医学科学领域更广泛的应用打下基础。
该工作也得到了上海中医药大学的李琦教授的支持。文章最近在Proc. Natl. Acad. Sci. U.S.A 在线发表,南佛罗里达大学桑鹏博士、石岩博士和Moffitt癌症研究中心张珉博士为文章的共同第一作者,蔡健峰教授、季海涛教授以及李琦教授为文章的共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Inhibition of β-catenin/B cell lymphoma 9 protein−protein interaction using α-helix–mimicking sulfono-γ-AApeptide inhibitors
Peng Sang, Min Zhang, Yan Shi, Chunpu Li, Sami Abdulkadir, Qi Li, Haitao Ji, and Jianfeng Cai
PNAS, 2019, DOI: 10.1073/pnas.1819663116
导师介绍
蔡健峰
https://www.x-mol.com/university/faculty/47852
课题组主页
http://jianfengcai.myweb.usf.edu/
季海涛
https://www.x-mol.com/university/faculty/41634
课题组主页
http://labpages2.moffitt.org/ji/
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号