铜、铁双金属掺杂多面可降解介孔二氧化硅纳米颗粒用于肿瘤化学动力学治疗
近年来癌症治疗方法的研究越来越广泛,除传统的化疗、放疗外,利用光激发产生具细胞毒性的活性氧杀死肿瘤细胞的光动力治疗也成为研究热点。然而,由于光的穿透深度不足,即使近红外光在人体的穿透深度也只能达到2-3 cm,导致该疗法的适用性受到限制。而化学动力治疗则是在不需要外部刺激的情况下,通过铁、铜、锰等金属元素在细胞内催化芬顿(Fenton)、类芬顿(Fenton-like)反应,产生羟基自由基,同时激活细胞“铁死亡(Ferroptosis)”通路,调节细胞内氧化型与还原型谷胱甘肽比例,抑制谷胱甘肽过氧化物酶4(GPX4),促使脂质过氧化,从而杀死肿瘤细胞。
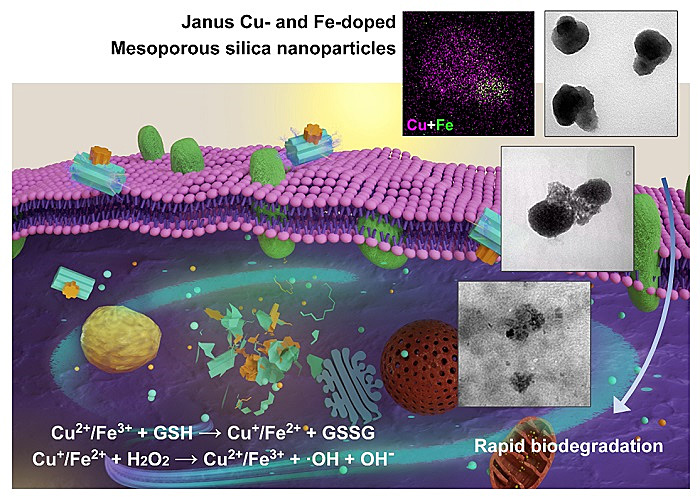
近日,华侨大学生物材料与组织工程研究所陈爱政教授(点击查看介绍)团队通过铜、铁双金属掺杂构建多面可生物降解的介孔二氧化硅纳米颗粒(Janus-type nanoarchitectures, Cu-Fe-MSNs),为纳米颗粒的化学动力学治疗(chemodynamic therapy, CDT)提供新思路。
研究工作通过改进Stöber法一步合成铜、铁双金属掺杂的多面介孔二氧化硅纳米颗粒。
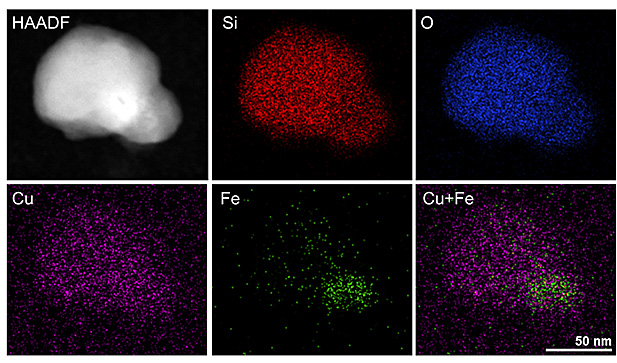
Cu-Fe-MSN的TEM mapping
一方面,金属铜、铁能与化疗药物阿霉素的氨基配位结合,提供化疗药物的pH响应控释。另一方面,由于金属掺杂,赋予介孔二氧化硅的快速生物降解性能,Cu-Fe-MSNs展示了很好的pH依赖快速降解性能。

Cu-Fe-MSNs在(A)完全培养基,(B)pH 7.4的PBS和(C)pH 5.0的PBS后的TEM图以及(D)水合粒径
同时利用铜、铁催化细胞内芬顿、类芬顿反应,并随着金属在胞内发挥作用,激活细胞“铁死亡”通路,调节细胞内氧化型与还原型谷胱甘肽比例,抑制GPX4,促使脂质过氧化,从而杀死肿瘤细胞。
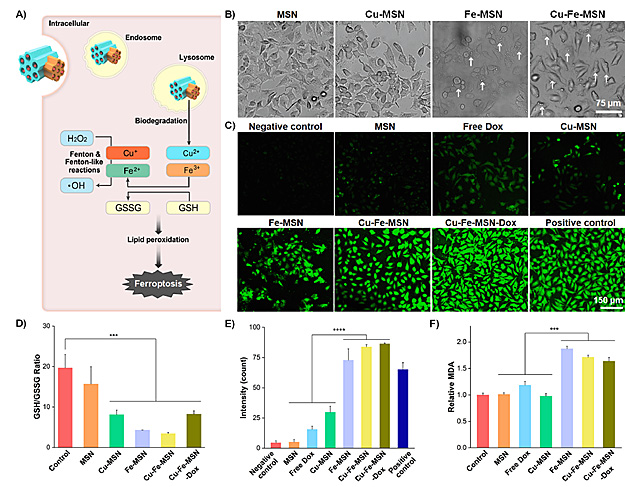
(A)细胞内作用示意图。不同样品处理后(B)细胞形态图,(C)细胞内ROS水平荧光照片,(D)氧化型、还原型谷胱甘肽比例,(E)细胞内ROS水平,(F)脂质过氧化程度。
这一成果近期发表在Chemical Engineering Journal上,文章的通讯作者为华侨大学生物材料与组织工程研究所陈爱政教授和Ranjith Kumar Kankala博士,共同第一作者是华侨大学2018级博士研究生刘晨光和2018级硕士研究生韩雅卉。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Rerouting engineered metal-dependent shapes of mesoporous silica nanocontainers to biodegradable Janus-type (sphero-ellipsoid) nanoreactors for chemodynamic therapy
Chen-Guang Liu, Ya-Hui Han, Jian-Ting Zhang, Ranjith Kumar Kankala, Shi-Bin Wang, Ai-Zheng Chen
Chem. Eng. J., 2019, DOI: 10.1016/j.cej.2019.03.272
陈爱政教授简介
四川大学生物医学工程专业博士(2007),香港理工大学博士后(2007-2009),哈佛医学院、哈佛大学-麻省理工学院HST访问学者(2015-2016)。目前担任中国生物材料学会复合材料分会秘书长、华侨大学生物材料与组织工程研究所所长、福建省科技创新团队带头人、福建省博士生导师团队带头人。主要从事超临界流体技术及生物材料与组织工程领域的研究,主持国家自然科学基金海峡联合重点项目、面上项目、国家重点研发计划重点专项子任务等国家级课题6项。
陈爱政
https://www.x-mol.com/university/faculty/63918
课题组主页
https://www.x-mol.com/groups/hqubiomat
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号