驱动力增强,反应速率却减缓?Science报道PCET领域重大突破 — 解读 | 专访 | 点评
副标题:Marcus反转区内的协同质子耦合电子转移反应
供稿:北卡罗来纳大学教堂山分校 刘天飞 博士
专访:瑞典乌普萨拉大学 Leif Hammarström 教授
点评:北卡罗来纳大学教堂山分校 Thomas J. Meyer 教授
质子耦合电子转移(PCET)反应是一类广泛存在于化学、生物学和物理学体系中的基元反应,普遍存在于在光合作用、呼吸作用、燃烧过程、燃料电池、太阳能燃料、催化及有机合成过程中的化学能量转化与储存过程。PCET这一基元反应的概念自美国化学家Thomas J. Meyer(生于1941年,现就职于北卡罗来纳大学教堂山分校)在1981年提出以来[1],越来越受到人们的关注。在PCET过程中,电子(Electron)和质子(Proton)可以通过协同的途径(Concerted Proton-Electron Transfer, CPET or CEPT)亦或分步的途径(ETPT或者PTET)发生耦合式的转移;其中通过协同途径电子和质子可以同时发生转移且只经历单一的过渡态,避免了分步途径中所经历的高能量中间体的形成,从而实现反应热力学驱动力的最优化。
美国化学家Rudolph A. Marcus(生于1923年,现就职于加州理工学院)在反应过渡态理论以及化学反应中的外层电子转移理论建树颇丰。由于在化学体系中外层电子转移理论(即“Marcus理论”)的贡献,他获得1992年的诺贝尔化学奖。Marcus理论为外层单电子转移构建了非常重要的热力学和动力学理论框架[2]。根据Marcus理论,人们可以做出如下预测:对于一个非绝热单电子转移过程,当反应的驱动力(-ΔG0)远远大于反应的重组能(λ)时,电子转移的速度可以随着反应驱动力的增大而减小,即人们所熟知的“Marcus反转区”。该反转区的存在于1984年被J. R. Miller课题组通过实验所证实 [3],并被国际主流科学界所认可(图1A)。近年来,在核子转移反应过程领域,人们将Marcus理论进行了进一步理论扩展,并且通过实验发现了质子转移过程中与理论吻合的反转区 [4](图1B)。
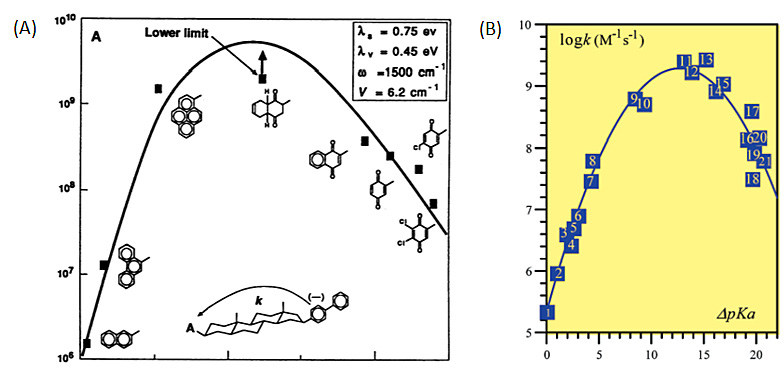
图1. (A)J. R. Miller 于1984年首次发现的外层电子转移中的Marcus反转区(图片来源:Science)(B)J.-M. Savéant于2003年首次发现质子转移中的Marcus反转区(图片来源:J. Am. Chem. Soc.)
最近,瑞典乌普萨拉大学Leif Hammarström教授课题组和美国耶鲁大学James M. Mayer教授课题组在Science 上首次报道了协同质子耦合电子转移反应(CPET)存在Marcus反转区的实验证据,并且联合耶鲁大学Sharon Hammes-Schiffer教授课题组进行了理论总结。该工作不仅拓宽了人们对质子耦合电子转移反应的认识边界,也为进一步认识电子-质子耦合转移的作用机制提供了新的研究平台。同时,CPET过程中的Marcus反转区的存在可以减缓电荷分离态(Charge-Separated State, CSS)发生电荷复合(Charge Recombination, CR)反应的速率,为认识和发展有效的太阳能转换体系提供了全新的思路和理论基础。
作者设计并且合成了一系列将光敏官能团蒽环1位通过亚甲基共价连接的吡啶联苯酚衍生物(化合物1-8)。作者从研究的光激发诱导的协同质子耦合电子转移反应机理过程出发对分子进行了精妙的设计(如图2所示):第一步,处于基态(Grand State, GS)的分子中的光敏基团蒽被紫外光激发生成局域激发态(Local Excited State, LES);第二步,紧接着LES态可以发生分子内的协同电子质子转移生成电荷分离态(CSS),即在分子内碱的协助下电子从苯酚转移到激发态的蒽官能团,分别形成蒽负离子自由基(An•-)和酚氧自由基。第三步,随后通过PCET反应发生电荷复合回到基态(GS),即电子从负离子蒽自由基上重新注入酚氧自由基的同时发生分子内质子转移返回初始态的蒽和苯酚。同时,作者通过对光敏基团蒽环6位以及分子内碱基团吡啶上的取代基电子效应的有序调控进一步探索了上述PCET过程的反应动力学与热力学驱动力之间的相互关系。
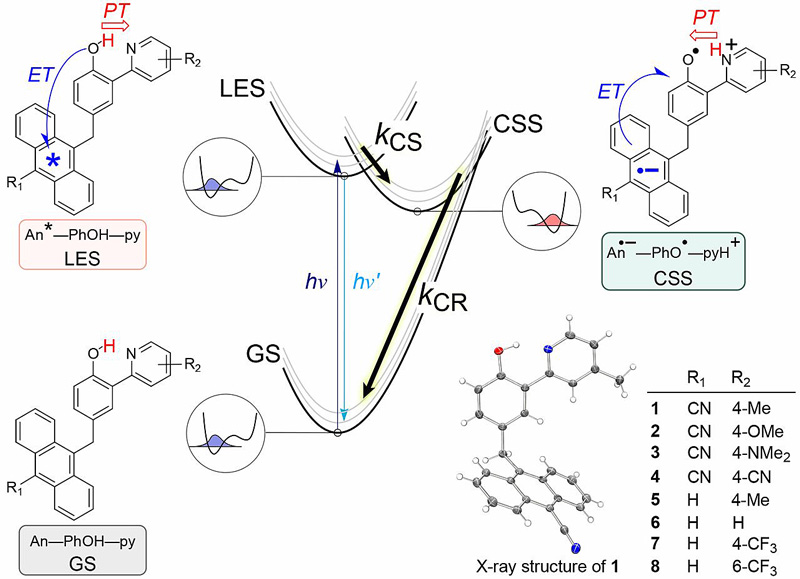
图2. 化合物1-8的结构信息,以及整个体系所经历的反应机理。图片来源:Science
Leif Hammarström课题组利用飞秒激光光谱技术对上述激发过程的光谱跟踪及反应动力学监测;在此基础上采用串联反应动力学模型对该动力学信息进行了拟合。对于含有氰基取代的化合物1-4,作者也利用氰基在中红外区的吸收特征峰对其动力学行为进行了详细的研究(图3)。通过动力学分析,作者发现电荷分离(CS)步骤和电荷复合(CR)步骤中电子和质子的转移都是通过协同反应机理实现的。对于化合物1-3在二氯甲烷中的CS反应步骤,其动力学同位素效应(KIEs)为1.7±0.2;而相应化合物CR反应步骤的动力学同位素效应为1.0±0.1,并且其动力学常数与相应质子化吡啶盐的pKa数值有非常好的相关,这种相关在不同极性的溶剂中都存在。而对于溶剂的研究,作者发现溶剂极性会显著影响CR反应步骤的速率,极性越强其CR反应速率越快,即,DMF中的反应速率 > 正丁基腈中的反应速率 > 二氯甲烷中的反应速率。
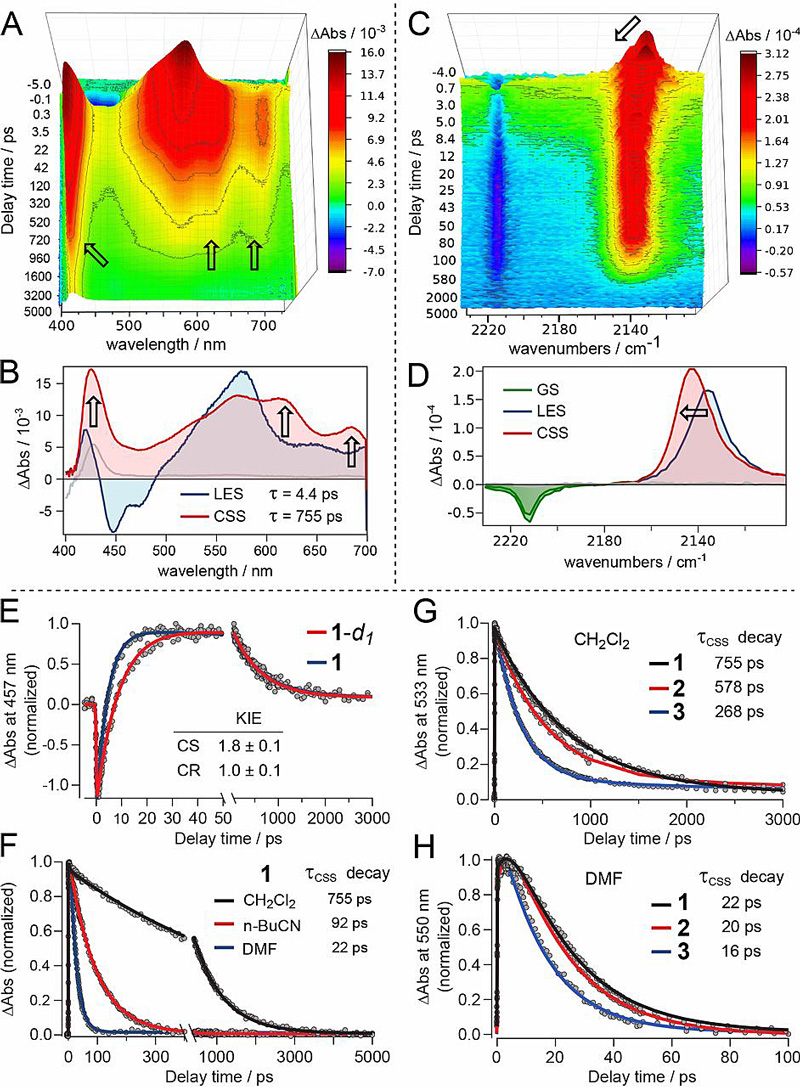
图3. 体系的飞秒闪光光解跃迁吸收光谱(紫外可见和中红外)、中间体电荷分离态(CSS)的表征,以及反应动力学拟合。图片来源:Science
通过实验测量并且辅助密度泛函理论(DFT)计算模拟,作者定量研究了CS反应步骤和CR反应步骤所对应的反应驱动力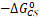 和
和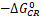 。将反应速率常数的自然对数相应反应驱动力作图(图3),作者发现对于所有的化合物1-8,在不同溶剂中其CS反应步骤的速率常数分布在正常Marcus相关区,并且和
。将反应速率常数的自然对数相应反应驱动力作图(图3),作者发现对于所有的化合物1-8,在不同溶剂中其CS反应步骤的速率常数分布在正常Marcus相关区,并且和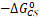 有一个比较好的抛物线函数相关。作者发现对于化合物1-3的CR反应步骤,虽然相应的反应驱动力是远远大于相应CS反应步骤,但在同一种溶剂中所观测到的CR反应速率都是远远小于相应的CS反应步骤;不同溶剂中的所有CR反应速率和
有一个比较好的抛物线函数相关。作者发现对于化合物1-3的CR反应步骤,虽然相应的反应驱动力是远远大于相应CS反应步骤,但在同一种溶剂中所观测到的CR反应速率都是远远小于相应的CS反应步骤;不同溶剂中的所有CR反应速率和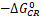 有一个比较好的抛物线函数相关。由于在不同溶剂中存在不同的重组能λ数值,部分数据不能完美地用二次函数进行拟合,但它们还是分布在一个完美的钟形抛物线上。
有一个比较好的抛物线函数相关。由于在不同溶剂中存在不同的重组能λ数值,部分数据不能完美地用二次函数进行拟合,但它们还是分布在一个完美的钟形抛物线上。
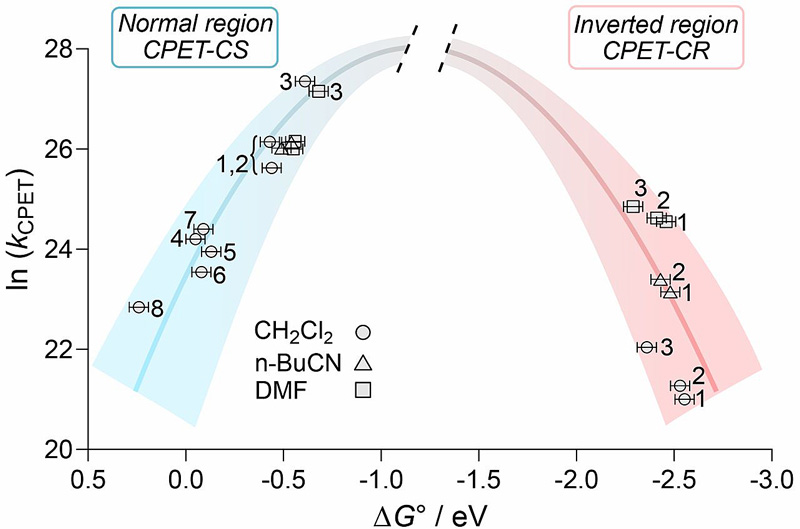
图4. 协同质子耦合电子转移反应(CPET)反应速率的自由能相关显示了Marcus正常区和反转区。图片来源:Science
结合Mayer和Hammes-Schiffer课题组对该体系的理论研究,作者在理论层次细致分析了在非绝热状态下进入反转区的原因,并对相应的重组能进行了深入的探讨。该工作首次在实验上观测到质子耦合电子转移过程的动力学行为出现在Marcus反转区的现象,为认识和理解质子耦合电子转移这一类重要反应提供了全新的视角,具有十分重要的理论意义。有兴趣的读者可以在原文和支持材料中进一步阅读。
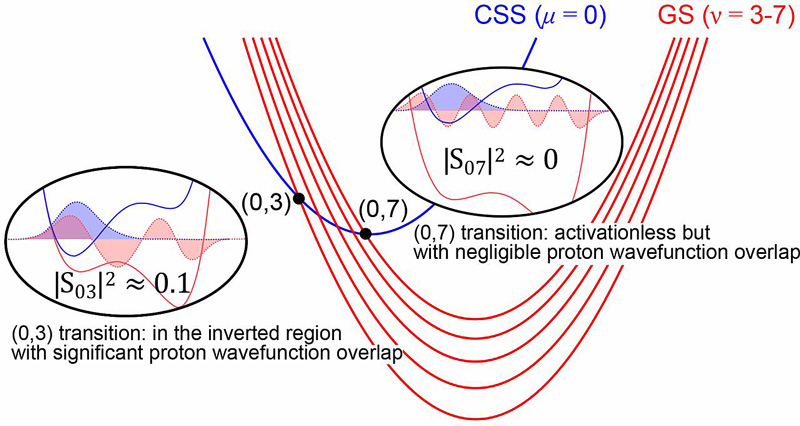
图5. 对于本文中协同质子耦合电子转移-电荷复合(CPET)反应过程中最低电荷分离态(CSS,蓝色)和基态产物(GS,红色)振动态自由能曲线示意图。图片来源:Science
综上所述,在太阳能转换和其他过程中,单纯的电子转移的Marcus反转区已经被证明是一个减缓电荷分离能量储存后电荷复合反应速率的重要因素。而对于PCET反转区的发现,有利于人们进一步理解自然界的光合作用中的电子和质子转移的详细过程(图6);并且在人工光合作用领域将为人们控制和理解关于电子和质子转移相关的反应带来新的策略,以此促进太阳能燃料(Solar Fuel)的生产以实现太阳能至化学能的有效化学转化。在同期的Science 上,来自北卡罗来纳大学教堂山分校的Jillian Dempsey对该工作进行了评论,也对相关领域的未来发展做出了展望[5]。
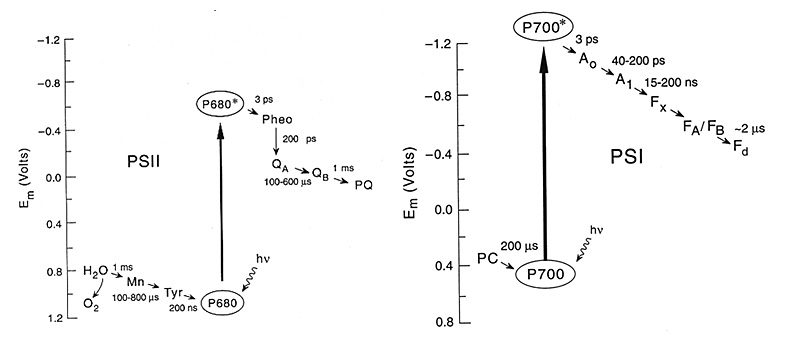
图6. 自然界的光合作用过程中光系统II(PS II)和光系统I(PS I)在光激发下电子转移路径和速率示意图[6]。

图7. Leif Hammarström课题组的超快动力学平台。图片来源:Leif Hammarström课题组
Leif Hammarström教授专访纪要(后付英文原文)
X-MOL:
可否请您简单介绍一下“Marucs理论”与“Marcus反转区”,以及其重要意义?
Hammarström教授:
R. A. Marcus 在1956年首次发表了他的电子转移(ET)理论 [2]。电子转移是化学、生物学以及物理学众多领域中重要的基元反应,该理论在对该基元反应的预测和理性认识中取得了巨大的成功。基于电荷在介电质(dielectric media)中的溶剂化的基本概念,Marcus推导出一个简单的数学公式去描述反应能垒和反应驱动力的关系,以及用以描述反应物与产物之间溶剂化变化的重组能(reorganization energy)。
Marcus在1956年就已经提出了一个惊人的预测,对于一个高度放能的电子转移反应,反应的速率常数会随着反应驱动力大大升高而下降,这一区域被称为Marcus反转区(MIR)。当时Marcus反转区没有被任何人观测到,所以当时对于很多学者而言这个预测是反直觉的。然而,在多次尝试之后,第一例Marcus反转区的识别与实验证明在1984年由Closs、Miller及其同事发表 [3]。
Marcus反转区对于高度放能反应(highly exergonic reactions)非常重要。这类高度放能反应的代表之一是光合作用中的电荷复合。
2009年,我们的同事Sharon Hammes-Schiffer课题组曾经预测质子耦合电子转移(PCET)的Marcus反转区在实验可行的条件下可能并不能被观测到[7]。其原因在于很多可能的质子震动激发态(excited proton vibrational states)也可以作为一种受体态。这意味着,光化学质子耦合电子反应的复合过程本身会更快,因此也带来获得高能量转换效率的问题;而太阳能燃料的生成过程是这类光化学质子耦合电子反应的典型代表。
X-MOL:
具体到这篇Science 论文,是如何产生探索协同质子耦合电子转移的想法的?是先从理论出发还是先从实验现象出发解决科学问题?
Hammarström教授:
我们三个课题组(Hammarström、Sharon Hammes-Schiffer和James Mayer)在过去数年一直在分别从不同的视角研究质子耦合电子转移。Mayer课题组首次将蒽染料官能团共价引入苯酚吡啶分子 [8]。他们这样设计的目的是避免反应物之间的扩散步骤,直接研究体系的超快质子耦合电子转移反应。他们发现该体系的质子耦合电子转移(PCET)反应速率和反应温度完全不相关,甚至在低温下反应速率也可以达到皮秒数量级。他们将这些结果在2014年在瑞典举行的PCET2014大会上进行了报告和讨论,那一次大会使得我们三个课题组能聚在一起,并且迈开了我们这个项目合作的第一步。我们希望能探索一系列具有不同反应驱动力的化合物,并且希望考察反应速率和反应的活化能是否和数年前Hammes-Schiffer课题组发展得理论模型相吻合。此外,我们希望能识别出电荷分离态(CSS),并且使用飞秒激光光谱在可见和红外区跟踪该类型物种的复合过程。这些光谱学和动力学实验是在我的课题组完成的。
其实我们最初并没有预期我们会发现这些化合物会出现Marcus反转区行为。事实上,我们中的大部分人最初并不相信复合过程会是一个协同的PCET过程,而觉得可能是一个纯粹的电子转移过程(ET)跟随着一个质子转移过程(PT)。很幸运我们最终观测到了一个让人惊喜的结果。

图8. 本工作的起点:2014年在乌普萨拉大学举办的第二届国际质子耦合电子转移大会(PCET2014)合影,拍摄于斯库克洛斯特城堡(Skokloster Wärdshus)。
X-MOL:
这个项目所遇到的最大挑战是什么?是如何解决的?
Hammarström教授:
这个项目的一大挑战在于一开始我们设计的化合物并没有在相应的电荷分离态中间体出现非常明显的信号。当我们提升取代基的氧化性和更强的分子内碱性时,我们发现了中间体明显的光谱信号,并且可以使我们跟踪随后的电荷复合PCET反应。另一大挑战在于从实验和理论计算数据对结果的精细分析,从而获得精确的中间体状态能量和反应驱动力数据。
专家点评(后付英文原文)

图9. PCET概念提出者Thomas J. Meyer教授。图片来源:北卡罗来纳大学教堂山分校
化学物种之间的电子转移是化学领域中的关键反应,其规律已经被深刻认识。质子耦合电子转移(PCET)是一类质子转移和电子转移都要发生的反应。但质子耦合电子转移(PCET)要比单纯的电子转移(ET)后紧接着质子转移(PT)复杂,因为质子耦合电子转移(PCET)牵涉到质子和电子的同时转移。然而,对于具有高能垒的电子转移,质子可能先直接发生转移或者通过协同的质子耦合电子转移以掌控整个反应的性质。协同质子耦合电子转移过程(CPET)常常是有机反应的首选,因为对于分步的反应会产生一个高能量的自由基中间体,对反应不利。为了避免高能量中间体的生成,有机底物的生物学反应通常选择协同电子耦合质子转移的反应路径。
该Science文章中所报道的PCET反应性是一种极限的条件,适用于高驱动力有利的反应类型,例如激发态这种具有高驱动力的反应体系。
这个工作是由领域中非常有能力的几个课题组完成的。他们的结果对于我们对于新型反应类型的理解非常重要,并且对于我们理解相关反应的意义、以及探索未知的反应类型同样非常重要。
致谢
本文感谢乌普萨拉大学Leif Hammarström、北卡教堂山分校Thomas J. Meyer、耶鲁大学Sharon Hammes-Schiffer和Giovanny A. Parada的邮件讨论;感谢耶鲁大学James Mayer和乌普萨拉大学Belinda Pettersson Rimgard的支持与协助。
参考文献:
1. Binstead, R. A.; Moyer, B. A.; Samuels, G. J.; Meyer, T. J., Proton-coupled electron transfer between [Ru(bpy)2(py)OH2]2+ and [Ru(bpy)2(py)O]2+. A solvent isotope effect (kH2O/kD2O) of 16.1. Journal of the American Chemical Society, 1981, 103 (10), 2897-2899.
2. Marcus, R. A., On the Theory of Oxidation‐Reduction Reactions Involving Electron Transfer. I. J. Chem. Phys., 1956, 24 (5), 966-978.
3. Miller, J. R.; Beitz, J. V.; Huddleston, R. K., Effect of free energy on rates of electron transfer between molecules. Journal of the American Chemical Society, 1984, 106 (18), 5057-5068.
4. Andrieux, C. P.; Gamby, J.; Hapiot, P.; Savéant, J.-M., Evidence for Inverted Region Behavior in Proton Transfer to Carbanions. Journal of the American Chemical Society, 2003, 125 (33), 10119-10124.
5. Dempsey, J. L., How a highly driven reaction hits the brakes. Science, 2019, 364 (6439), 436-437.
6. Singhal, G.; Renger, G.; Sopory, S.; Irrgang, K., Concepts in photobiology: photosynthesis and photomorphogenesis. Springer Science & Business Media: 2012.
7. Edwards, S. J.; Soudackov, A. V.; Hammes-Schiffer, S., Driving Force Dependence of Rates for Nonadiabatic Proton and Proton-Coupled Electron Transfer: Conditions for Inverted Region Behavior. The Journal of Physical Chemistry B, 2009, 113 (44), 14545-14548.
8. Bowring, M. A.; Bradshaw, L. R.; Parada, G. A.; Pollock, T. P.; Fernández-Terán, R. J.; Kolmar, S. S.; Mercado, B. Q.; Schlenker, C. W.; Gamelin, D. R.; Mayer, J. M., Activationless Multiple-Site Concerted Proton–Electron Tunneling. Journal of the American Chemical Society, 2018, 140 (24), 7449-7452.
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Concerted proton-electron transfer reactions in the Marcus inverted region
Science, 2019, 364, 471-475, DOI: 10.1126/science.aaw4675
附录:
Interview with Prof. Leif Hammarström
1. Could you please briefly introduce “Marcus theory” and “Marcus inverted region”, as well as their significance in Chemistry?
R. A. Marcus published the first parts of his theory on electron transfer (ET) reactions in 1956, and this has been tremendously successful in predicting and rationalizing this fundamental reaction, that is an elementary step in many fields of chemistry, biology and physics. Based on general concepts of solvation of charges in dielectric media, Marcus could derive a mathematically simple relation describing how the reaction barrier depends on reaction driving force and the so-called reorganization energy, where the latter describes changes in solvation between reactants and products.
A surprising prediction already in 1956 was that the rate constant for highly exergonic ET reactions would decrease if the driving force was further increased, and this region was denoted Marcus Inverted Region (MIR). The MIR had not been observed for any reaction so far, and was counter-intuitive to many researchers. However, after many attempts, the first generally recognized and clear demonstration of MIR was published by Closs, Miller and coworkers in 1984.
The MIR is important in slowing down highly exergonic reactions, such as energy-wasting charge recombination in photosynthesis.
For proton-coupled electron transfer (PCET), one of our groups (the Hammes-Schiffer group) had predicted in 2009 that the MIR would not be observed in PCET reactions under experimentally accessible conditions, because of the many possible excited proton vibrational states that could work as alternative acceptor states. This would imply that recombination of photochemical PCET reactions – such as those involved in solar fuel formation – may be intrinsically faster and thus more of a problem for obtaining high energy conversion efficiencies.
2. In the new Science paper, how did your team come up with the idea of exploring concerted proton-electron transfer reactions? Which inspired you first to solve such a scientific problem, theoretical findings or experimental phenomenon?
Our three groups have separately examined different aspects of proton-coupled electron transfer for several years. The Mayer group had designed a first molecule in which an anthracene dye was covalently linked to a phenol-pyridine molecule. Their purpose was to study ultra-fast PCET in systems where reactants do not have to diffuse together prior to reactions. They found that the PCET rate constant was remarkably independent on temperature, and PCET occurred on a ps time scale even at cryogenic temperatures. The results were presented and discussed at the PCET 2014 conference in Sweden, where all three groups were present and our first steps of this collaborative project were taken. We wanted to explore a range of related compounds in which the driving force was varied, and see if the variation of rates and activation energies could be described by the theoretical models developed over the years by Hammes-Schiffer and her group. Moreover, we wanted to clearly demonstrate the charge separated state and follow its recombination using fs-laser spectroscopy in the visible and infrared regions, which is done in the Hammarström group.
We did not expect to find a MIR behavior for these compounds. In fact, many of us believed that the recombination reaction would not be a concerted PCET reaction, but perhaps a pure ET reaction followed by proton transfer.
3. What was the biggest challenge in this project? And how was it conquered finally?
One challenge was that the first series of compounds did not show clear signals of the charge separated state. When we substituted the molecules with strong photo-oxidants and strong bases, however, we found clear spectroscopic features and could follow the charge recombination PCET reaction. Another challenge was in the detailed analysis, obtaining sufficiently accurate state energies and driving forces, from experimental and computational data.
Comments from Prof. Thomas J. Meyer
Electron transfer between chemical sites is a key reaction in chemistry with the rules understood. PCET is a subset of electron transfer for reactions where both proton transfer and electron transfer have to occur. PCET is more complex than electron transfer followed by proton transfer, because it involves the simultaneous transfer of both electrons and protons. However, for cases where electron transfer has a high barrier, it may be easier to transfer the proton directly and PCET can dominate reactivity. The latter is often the case in organic reactions where the other option, electron transfer to give an intermediate free radical, is highly unfavorable. To avoid radical intermediates, biological reactions involving organic substrates typically prefer PCET.
The appearance of PCET reactivity, as described in the Science paper, is a limited phenomenon and should appear only for highly favored reactions, perhaps even in excited states, where there is a large driving force.
The paper features input in this area from some very capable research groups who deal with chemical reactivity in solution. The results are significant in extending our understanding to a new type of reactivity with important implications for understanding related reactions in the future and, in filling, in a reactivity blank.
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号