肿瘤微环境内的中性粒细胞或是治疗新突破口
本文获“BioArt”授权转载,版权归“BioArt”所有,任何转载需获得“BioArt”授权。
机体在遭受感染和炎症时,中性粒细胞会首先做出反应。中性粒细胞在适应不同的背景环境时,会呈现出不同的功能。中性粒细胞能够抵抗病原体的感染,然而持续不断的中性粒细胞的浸润会导致慢性炎症以及不断的组织损伤。有观点称肿瘤是一种“不会愈合的伤口”。肿瘤中存在慢性炎症存在大量中性粒细胞的浸润。在肿瘤微环境中,中性粒细胞被分为N1/N2型中性粒、肿瘤相关的中性粒(Tumor-associated neutrophil TAN)以及分叶核髓系来源抑制性细胞(Polymorphonuclear-myeloid derived suppressor cellPMN-MDSC)【1】。
在肿瘤发生的早期中性粒细胞类型主要为N1型。N1型中性粒细胞通过分泌I型干扰素和激活NK细胞的IL18而具有抗肿瘤的功能。在肿瘤发展的过程中N2型中性粒细胞不断增多。N2型中性粒细胞会分泌ROS、精氨酸酶和过氧化物酶等分子,抑制T细胞和NK细胞功能,达到促进肿瘤的作用【2】。中性粒细胞在肿瘤微环境中功能类型的转换依赖于肿瘤微环境,但具体机制尚不清楚。研究发现如果抑制了TGF-β信号,则能够增加N1型中性粒细胞。
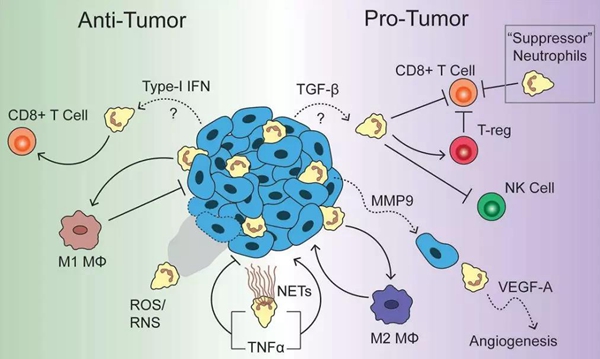
骨髓来源的抑制性细胞MDSC分为polymorphonuclear-MDSCs (PMN-MDSCs) 和monocytic-MDSCs (M-MDSCs)。二者都是不成熟的髓系来源的细胞和具有免疫抑制功能。PMN-MDSC在形态和功能都与N2型中性粒细胞非常相似,并且二者有共同的来源和分化通路。人的PMN-MDSCs 的分子标志为CD11b+CD14−CD15+/CD66b+,这些标志还不能完全区分开PMN-MDSCs和肿瘤相关中性粒。由于二者的细胞密度不同,利用梯度离心能够将两种细胞分开。关于PMN-MDSCs功能的调控机制研究不清楚。
近日,美国Wistar研究所的Dmitry Gabrilovich团队在Nature上发表文章Fatty acid transporter protein 2 reprograms neutrophils in cancer,发现在PMN-MDSCs中,Fatty acid transporter protein 2(FATP2)能够促进花生四烯酸的利用和前列腺素E2的合成,介导免疫抑制功能,抑制FATP2则可提升肿瘤治疗的效率。

研究表明肿瘤中的巨噬细胞、树突状细胞和MDSC中脂质会发生累积。作者首先对比PMN细胞和PMN-MDSCs,发现PMN-MDSCs拥有比较高浓度的脂质,尤其是花生四烯酸的含量。清道夫受体CD204介导树突状细胞中脂质的累积,却不能影响PMN-MDSCs细胞中脂质的积累。膜蛋白CD206、CD36和Fatty acid-binding proteins(FABPs)以及Fatty acid transport proteins(FATPs)这些分子都能调控脂质的累积。FATPs家族共有六个成员(FATP1-FATP6)。FATP是长链脂肪酸转运蛋白和乙酰辅酶A合成酶,促进脂肪酸的氧化和脂质的合成。对比PMN细胞和PMN-MDSCs,FATP2在PMN-MDSCs高表达。
FATP2缺失的小鼠皮下荷瘤的体积明显小于对照组。进一步检测发现FATP2的缺失不会影响CD8阳性T细胞的功能。PMNs细胞中特异性敲除FATP2的小鼠的肿瘤的体积仍会明显小于对照组。FATP2在PMNs中缺失导致PMN-MDSCs的CD8阳性T细胞抑制作用受损。全转录组RNA测序发现FATP2缺失的PMN-MDSCs细胞中促炎因子的表达。利用液相色谱-质谱联用(LC-MS)方法发现,FATP2缺失的PMN-MDSCs细胞中花生四烯酸以及花生四烯酸的代谢产物前列腺素E2都明显下降,总胆固醇酯则无明显变化。深入研究发现FATP2并不能影响PMN-MDSCs细胞中脂肪酸的代谢过程。前列腺素E2(PGE2)能够促进MDSCs的免疫抑制活性。
FATP2的启动子区域有转录因子STAT5的结合位点,并且诱导PMNs细胞分化的GM-CSF(粒细胞-巨噬细胞集落刺激因子,granulocyte-macrophage colony stimulating factor)能够激活STAT5。本文验证发现,GM-CSF激活的STAT5能够直接结合到FATP2的启动子区域,调控FATP2的表达。PMNs中STAT5缺失的小鼠的肿瘤的体积明显受到抑制。
分离临床中头颈癌、乳腺癌和肺癌病人外周血中PMNs,发现脂质的浓度、前列腺素E2(PGE2)和FATP2的表达高于健康人。肿瘤组织中的PMN-MDSCs的脂质含量也明显高于外周血PMN-MDSCs中脂质的含量。
FATP2的抑制剂lipofermata对于重度免疫缺陷小鼠NOD/SCID体内的肿瘤无明显效果,而对于免疫系统正常小鼠的皮下瘤则有明显抑制作用。lipofermata和CTLA-4的靶向抗体对于肿瘤有协同治疗的作用。已有报道称COX2的抑制剂通过抑制PGE2而抑制MDSC功能,促进肿瘤的治疗。但长期给予COX2抑制剂会导致血液性、心血管以及胃肠道病变【3】。特异性地抑制FATP2则能够特异性作用在FATP2表达量高的肿瘤组织,而不会对机体其他部位产生损伤,有效减少副作用。

FATP2的抑制剂lipofermata的专利拥有者Concetta DiRusso(右)与论文作者之一Paul Black(左),该抑制剂主要用于治疗代谢性疾病(肥胖和2型糖尿病)。Credit: Craig Chandler, University of Nebraska-Lincoln
原文链接:
https://doi.org/10.1038/s41586-019-1118-2
参考文献
1. Giese M, Hind L, Huttenlocher A. Neutrophil plasticity in the tumor microenvironment. Blood. 2019.
2. Zhou J, Nefedova Y, Lei A, Gabrilovich D. Neutrophils and PMN-MDSC: Their biological role and interaction with stromal cells. Seminars in immunology. 2018;35:19-28.
3. Fujita M, Kohanbash G, Fellows-Mayle W, Hamilton RL, Komohara Y, Decker SA, et al. COX-2 blockade suppresses gliomagenesis by inhibiting myeloid-derived suppressor cells. Cancer research. 2011;71:2664-74.

如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号