山东大学Nature Catalysis:岩藻糖基化复杂糖链的精准合成
糖类是蛋白质与核酸之外的第三类重要生命分子。与蛋白质和核酸的生物合成途径不同,糖链的体内生源合成是一个非模板驱动的过程,其产物呈现为结构相近、具有“微观不均一性”的复杂糖链混合物。例如,岩藻糖基化是各类糖链骨架的最常见修饰形式之一,然而已知的各类岩藻糖转移酶均不能在含有多个岩藻糖基化位点的复杂底物上实现位点专一性的α1,3-或α1,4-岩藻糖基化,只能得到不同岩藻糖基化程度的糖链混合物。因此,α1,3-或α1,4-岩藻糖基化复杂糖链的精准合成一直以来都是糖链合成中的一大挑战。
最近,山东大学国家糖工程技术研究中心曹鸿志教授(点击查看介绍)课题组在Nature Catalysis 上发表研究论文,运用他们所发展的重编程酶法模块化组装策略,首次实现了α1,3-和α1,4-岩藻糖基化复杂糖链的精准合成。国家糖工程技术研究中心博士研究生叶金凤为该论文第一作者,曹鸿志教授为通讯作者,山东大学为该研究唯一通讯单位。国家糖工程技术研究中心迟连利教授、肖敏教授、王凤山教授和上海交通大学王平研究员等课题组对本研究也做出了重要贡献。
岩藻糖是路易斯系列抗原(Lewis antigen,Le)等糖抗原决定簇(epitope)的重要结构单元(图1)。其中路易斯 x(Lex, 1)、唾液酸化路易斯 x(sLex, 2)、路易斯 y(Ley, 3)、嵌合型组织血型抗原ALey(4)和BLey(5)等抗原决定簇均由type 2二糖LN(LacNAc, Galβ1,4GlcNAc)经α1,3-岩藻糖基化等酶促合成步骤得到;而路易斯a(Lea, 6)、唾液酸化路易斯a(sLea, 7)、路易斯 b(Leb, 8)、嵌合型组织血型抗原ALeb(9)和BLeb(10)等抗原决定簇则以type 1二糖LNB(Lacto-N-biose, Galβ1,3GlcNAc)为共同底物经α1,4-岩藻糖基化等酶促合成步骤得到。含有路易斯抗原决定簇的各类复杂糖链可与蛋白质和脂质共价结合形成糖复合物或以游离寡糖或聚糖形式存在,能够介导或调节细胞间、细胞与细胞外环境的相互作用,在许多生理和病理过程中均发挥着至关重要的作用,在生物医学领域具有广阔的应用前景。例如,Lex、sLex、Ley和sLea是常见的肿瘤相关糖抗原(TACAs),它们已被用作肿瘤临床诊断的生物标志物和免疫治疗靶点。
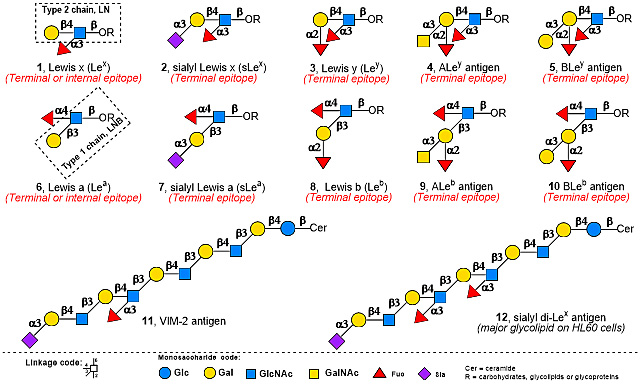
图1. Lewis系列抗原表位结构和选择性岩藻糖基化抗原结构。图片来源:Nat. Catal.
Lewis系列抗原的生物合成涉及多个α1,3-和α1,4-岩藻糖糖基转移酶(FucT),这些酶以非位点专一性的方式催化糖链骨架的岩藻糖基化,得到不同岩藻糖基化程度的混合物。虽然目前可使用化学法或酶法合成部分结构确定的Lewis抗原决定簇,但还没有一种酶促合成途径可以在糖链骨架的多个岩藻糖基化位点上精准地引入岩藻糖。为了解决这一难题,作者发展了一种创新性的合成策略,通过对糖链组装模块的重新编程,从而精确控制复杂糖链骨架的定点岩藻糖基化修饰。
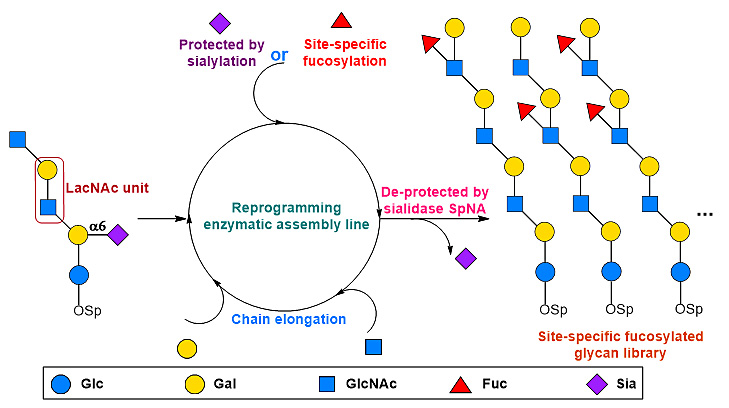
图2. 多聚乳糖胺的定点岩藻糖基化修饰。图片来源:Nat. Catal.
该研究中,作者首先考察了2种岩藻糖转移酶、1种唾液酸转移酶和1种乙酰氨基葡萄糖基转移酶的底物专一性。这4种糖基转移酶均来源于微生物,易于在大肠杆菌体系中表达,和哺乳动物来源的的糖基转移酶相比,其催化活性好,表达量较高,底物适应性较宽。其中,幽门螺杆菌来源的α1,3-岩藻糖糖基转移酶(Hpα1,3-FucT)和双功能α1,3/4-岩藻糖糖基转移酶(Hpα1,3/4-FucT)均能以type 2二糖LNβOSp和GlcNAc-LNβOSp为底物,分别生成LexβOSp和GlcNAc-LexβOSp,而Hpα1,3/4-FucT还能够以type 1二糖LNBβOSp和GlcNAc-LNBβOSp为底物生成LeaβOSp和GlcNAc-LeaβOSp(图3i)。但是,这两种岩藻糖转移酶对糖链骨架中的多个岩藻糖基化位点并没有选择性,不能得到结构确定的Lewis抗原。美人鱼发光杆菌来源的α2,6-唾液酸转移酶(Pd2,6ST)具有较宽的底物适应性,能够识别多聚乳糖胺(poly-LacNAc)骨架链的所有半乳糖,产生多唾液酸化产物,经α2,6-唾液酸修饰后的sLNβOSp,GlcNAc-sLNβOSp,sLNBβOSp和GlcNAc-sLNBβOSp均不能进行α1,3-或α1,4-岩藻糖基化反应(图3ii)。幽门螺杆菌来源的β1,3-N-乙酰氨基葡萄糖基转移酶(HpLgtA)可以识别LacNAcβOSp和LNBβOSp延伸poly-LacNAc聚糖链,但无论是唾液酸化或是岩藻糖基化LNβOSp和LNBβOSp,其产物均不是HpLgtA的识别受体,要在此基础上继续延伸糖链,非还原端GlcNAc单元是聚糖骨架延伸所必不可少的(图3iii)。
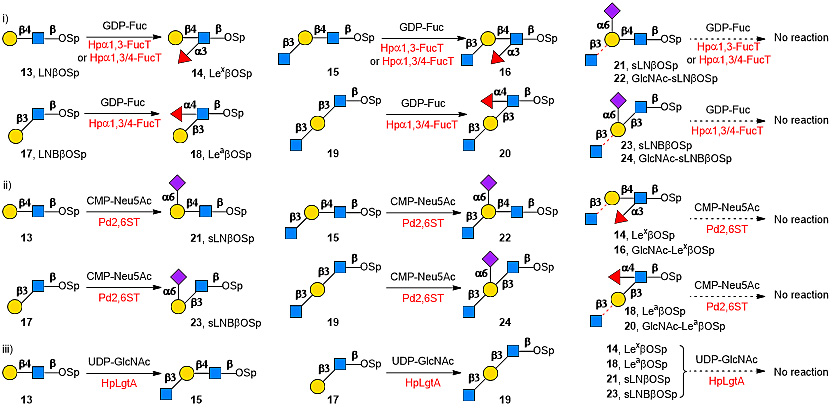
图3. Hpα1,3-FucT, Hpα1,3/4-FucT, Pd2,6ST 和 HpLgtA底物适应性考察。图片来源:Nat. Catal.
基于上述四种糖基转移酶的底物特异性,作者将与岩藻糖基化糖链体内生物合成无关的α2,6-唾液酸化组装模块整合到糖链组装线中,运用α2,6-唾液酸化和α1,3-或α1,4-岩藻糖糖基化的竞争反应来精准控制岩藻糖基化的修饰位点。该策略的关键在于在poly-LacNAc骨架延伸时,在不需要岩藻糖基化修饰的乳糖胺(LacNAc)或乳糖(Lactose)单元上使用唾液酸化模块引入α2,6-唾液酸作为临时保护基,使其不能被岩藻糖转移酶所识别,不被岩藻糖基化修饰,在需要岩藻糖基化的LacNAc单元上直接进行岩藻糖基化修饰,最后,将α2,6-唾液酸保护基用唾液酸苷酶切除,从而实现了poly-LacNAc糖链骨架的定点精准岩藻糖基化修饰。该研究运用10个酶法组装模块,共合成了22个结构均一的Lewis系列抗原复杂糖链(图4),为复杂天然岩藻糖基化寡糖的表征和定量提供了标准化合物,使得系统性研究这类复杂糖链家族的生物学功能成为可能。
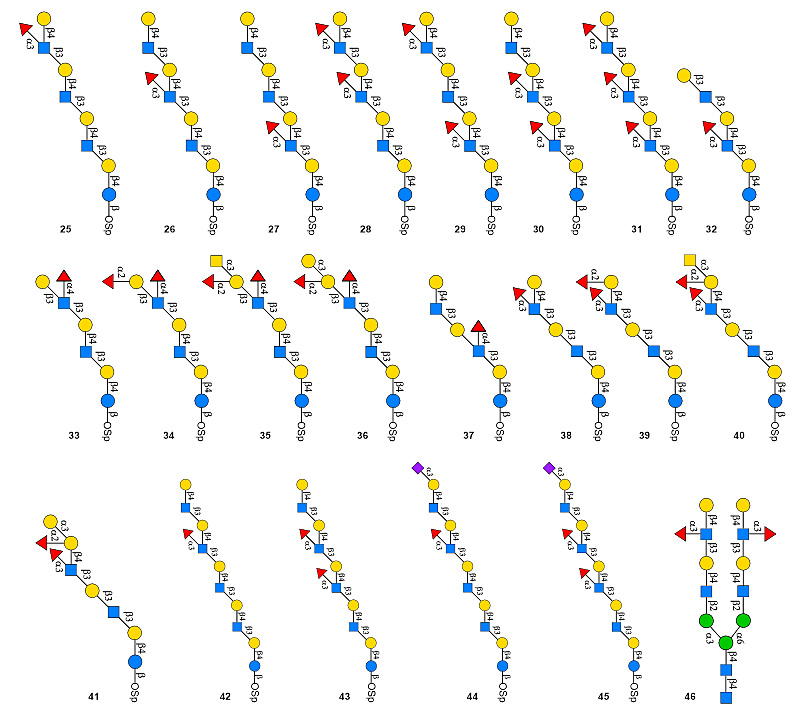
图4. 22个结构均一的Lewis系列抗原。图片来源:Nat. Catal.
曹鸿志教授课题组的研究工作主要聚焦于糖链高效合成这一糖科学研究领域的基础科学问题与关键制约瓶颈,创新性地发展了寡糖的酶法模块化组装策略,为糖链的高效合成提供了普适性的解决方案,实现了包括肿瘤相关糖抗原、人乳寡糖、血型抗原以及O-甘露聚糖等系列复杂人源寡糖库的构建。为了突破酶的底物应用范围与酶的来源限制,曹鸿志课题组将有机合成的理念、方法和策略引入寡糖的酶促合成,首次实现了唾液酸化糖链的可控合成(J. Am. Chem. Soc., 2014, 136, 5205; J. Am. Chem. Soc., 2019, 141, 4547.);本次发表的工作又首次实现了岩藻糖基化糖链的可控合成,是寡糖合成领域的重大突破。

曹鸿志教授(右一)和刘长城助理研究员(左一)以及研究生孙娜(左二)、夏慧(左三)、叶金凤(右二)
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Reprogramming the enzymatic assembly line for site-specific fucosylation
Jinfeng Ye, Hui Xia, Na Sun, Chang-Cheng Liu, Anran Sheng, Lianli Chi, Xian-Wei Liu, Guofeng Gu, Shu-Qi Wang, Jie Zhao, Ping Wang, Min Xiao, Fengshan Wang, Hongzhi Cao
Nat. Catal., 2019, DOI: 10.1038/s41929-019-0281-z
曹鸿志教授简介
曹鸿志,山东大学国家糖工程技术研究中心教授、博士生导师。该课题组采用重组、表达量高、底物适应性宽的细菌来源糖基转移酶和糖核苷酸合成相关酶,理性设计和构建了20余个酶法组装模块,发展了糖链酶法模块化组装策略,实现了系列复杂人源糖链的系统性合成,在J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、ACS Catal.等国际知名期刊发表了多篇论文。相关工作在国内外产生了非常积极的反响,曾获得首届“张树政糖科学奖”优秀青年奖(2015 年),J. Carbohydr. Chem.杂志社首届“Tomoya Ogawa Young Investigator” 奖(2016 年),任Carbohydr. Res.和 J. Carbohydr. Chem.编委(2016 年),作为负责人先后主持国家自然科学基金项目5项,以项目骨干参与973和863项目各1项。
https://www.x-mol.com/university/faculty/60198
(感谢论文作者对本文的支持!)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号