Nature:从“搅局者”到“带路党”,季碳中心指导的复杂萜烯合成
季碳中心普遍存在于天然产物(如萜烯类)和药物分子中,对于天然产物的生理活性或药物的代谢稳定性具有重要影响。萜烯类天然产物具有独特的多环稠合结构,部分分子虽然不具备丰富的反应活性官能团(如羰基、烯基、羟基等),但基于多环骨架的结构刚性,其具有良好的生物活性。更有趣的是,有时具有相同骨架的同类萜烯,仅仅因为其官能团不同而发挥截然不同的生理作用。例如,conidiogenone(9)在圆弧青霉菌(Penicillium cyclopium)发酵过程中孢子产生具有关键作用;conidiogenone B则能杀灭甲氧西林耐药的金黄色葡萄球菌(Staphylococcus aureus);而conidiogenone C却拥有纳摩尔级的细胞毒活性。如果能通过一种通用的策略完成这类分子的多样性合成,将有利于促进药物的发现。然而对于合成化学家来说,季碳中心在合成中十分具有挑战性,这种挑战也让有机合成化学家开发出了很多种创造性的方法和策略,比如,涂永强教授发展了用苯硫基辅助的半频哪醇重排构筑季碳化合物13(Angew. Chem. Int. Ed., 2016, 55, 4456)。总的来说,这类萜烯由于缺乏可用的官能团,在合成时更是难上加难,因此往往需要预先修饰官能团,由此导致合成步骤不够经济。
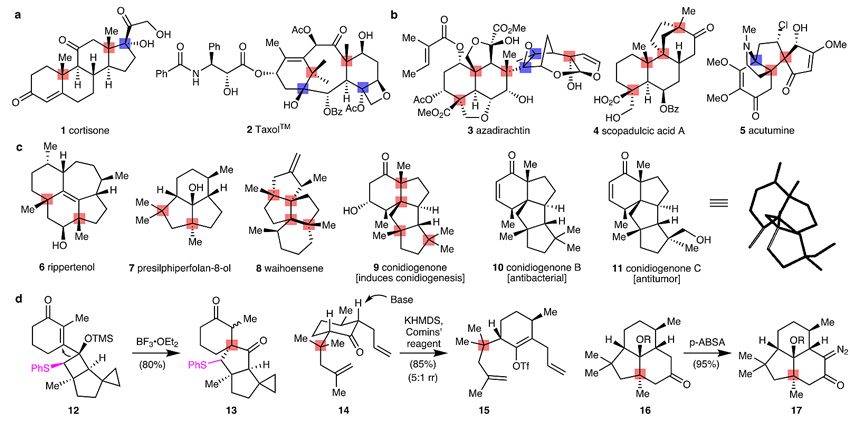
图1. 具有季碳中心的代表性天然产物和药物。图片来源:Nature
事实上,被不少人视为合成“搅局者”的季碳中心本身还有“带路党”属性,它的存在可促进某些结构的构建,如通过Thorpe–Ingold效应提高环化反应的速率、通过位阻效应提高反应选择性。Thorpe–Ingold效应是指当分子亚甲基上的两个氢原子被大体积的烷基取代后,该处内角被压缩,从而有利于分子链末端两个反应基团靠近而成环。比如,化合物14的α-选择性去质子化和16的α-选择性重氮化则是利用季碳中心的位阻效应来实现位置选择性(J. Am. Chem. Soc., 2017, 139, 5007)。
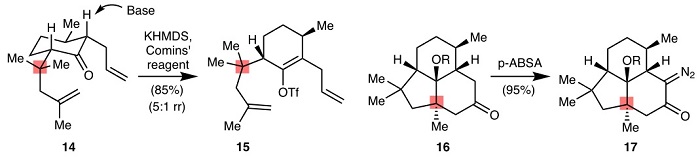
图2. 季碳中心驱动的反应。图片来源:Nature
基于季碳中心在合成中的特殊作用,近日美国芝加哥大学的Scott A. Snyder教授(点击查看介绍)课题组发展了一种利用季碳中心高效合成萜烯类化合物的方法,他们充分利用分子中的每一个季碳中心以指导其他季碳中心的构建,无需引入过多的官能团,由此简化分子的合成过程,并通过这一策略完成了conidiogenone家族化合物的高效模块化合成。相关工作发表在Nature 上,共同第一作者为Snyder组博士生胡鹏飞(Pengfei Hu)和Hyung Min Chi博士。
Conidiogenones家族化合物拥有共同的稠合四环骨架,其中包括四个季碳中心。经过大量的逆合成分析,他们认为蓝色标注的季碳是关键,可以通过它来引导其他三个季碳(黑色)的形成。他们从起始原料酮18出发,利用季碳的位阻效应选择性地氧化为α,β-不饱和烯酮19,后者利用Thorpe–Ingold效应促进环化构筑20中的第二个季碳。再次利用20中季碳的位阻效应选择性地烷基化后进行分子内Heck反应可产生第三个季碳,作者分析体系中可能存在两种Pd(II)中间体22和23之间的平衡,两者均无法进行β-H消除,由此可被氧亲核试剂捕获得到24,这种通过Pd(0)/Pd(II)催化循环,从非活化C(sp3)-Pd(II)中间体出发形成C-O键的方法尚无报道先例;随后通过NHK反应组装侧链25后,利用Thorpe–Ingold效应进行还原性的分子内Heck反应就完成第四个季碳中心的构筑,调整27分子骨架的氧化态可完成conidiogenones的全合成。
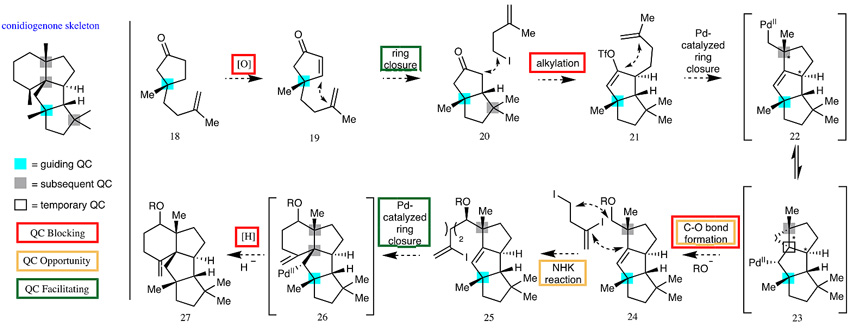
图3. 季碳中心指导的conidiogenones合成分析。图片来源:Nature
实践是检验理论正确与否的唯一标准。作者从酮18开始,区域选择性烯醇化后用IBX氧化形成烯酮19;19在Baran还原偶联的条件下(Fe(acac)3+PhSiH3)得到双环酮20;20烷基化后转化为三氟甲磺酸烯醇酯21,再在Pd(OAc)2催化下环化后被nBu4NOAc捕获,再水解得醇31,值得一提的是,这也是首次实现Pd催化C-C/C(sp3)-O键形成的串联反应;31 Dess-Martin氧化成醛32后在手性噁唑啉磺酰胺配体的参与下发生NHK反应,原位TMS保护基修饰可得到35;然后在Hermann催化剂作用下发生还原性Heck偶联/氢化得四环稠合中间体37;最后通过IBX氧化得到conidiogenone B,10环氧化/苯硒酚钠还原得到conidiogenone,L-selectride选择性还原羰基又得到conidiogenol,一切都按照设想按部就班地进行。同样的,conidiogenone C和D的合成遵循类似的路线,只需预先通过mCPBA氧化/Cp2TiCl2参与的自由基环化/MOMCl保护基修饰构筑双环中间体39和40。
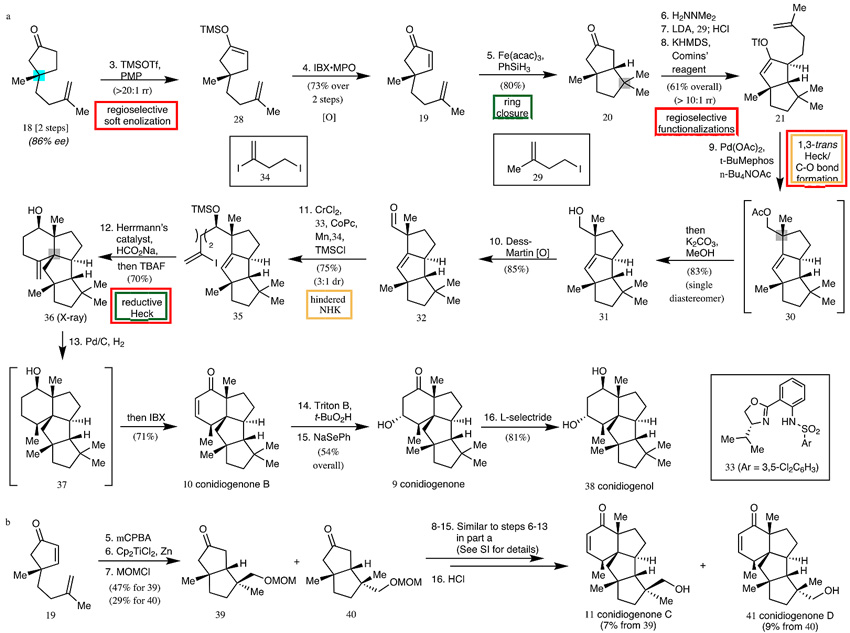
图4. Conidiogenones家族化合物的具体合成路线。图片来源:Nature
小结
全合成就像一场复杂的战争,除了扎实的战术训练外,更重要的是战略上的思考。Scott A. Snyder教授课题组重新认识到季碳中心在多环、多季碳的天然产物合成中的特殊战略地位,认为它不仅不是合成的难点和障碍,反而是促进反应和调节选择性的重要手段。同时,他们也坦言,这或许不是最佳的合成路线,但是却具有相当的普适性,尤其是在萜烯类化合物的合成上有很大潜力。另外,他们认为这一思想或许还可以扩展到其他复杂天然产物的合成中(如下图所示)。

图5. 季碳中心指导的多样性合成。图片来源:Nature
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Quaternary-centre-guided synthesis of complex polycyclic terpenes
Pengfei Hu, Hyung Min Chi, Kenneth C. DeBacker, Xu Gong, Jonathan H. Keim, Ian Tingyung Hsu, Scott A. Snyder
Nature, 2019, DOI: 10.1038/s41586-019-1179-2
导师介绍
Scott A. Snyder
https://www.x-mol.com/university/faculty/692
(本文由峰千朵供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号