Angew封面:多肽修饰的铂纳米颗粒化身特异性肝癌杀手
肝细胞癌(Hepatocellular carcinoma,HCC)是全世界第六常见的癌症,也是癌症相关死亡的第二大诱因。索拉菲尼是FDA批准的治疗晚期HCC最常用的药物,但是疗效不佳且有严重副作用,因此急需针对HCC的特异性抗癌药物。顺铂是一种有效的广谱化疗药物,但是副作用严重,研究表明铂纳米颗粒(platinum nanoparticles,PtNPs)是一种具有潜力的铂类药物替代品,但是过去的研究发现和顺铂相比,PtNPs的疗效和肿瘤选择性都没有显著的改善。
由于二价的铂离子才具有细胞毒性,而PtNPs中只有0价的铂离子,因此在细胞内需要先将之氧化成二价铂离子才能发挥抗癌作用。而肝癌细胞由于具有高浓度的活性氧,胞内氧化程度更强,因此PtNPs是一种很适合靶向HCC的抗癌药物。此前已经有研究使用键合了靶向分子的pH响应高分子修饰的PtNPs证明了这个观点。为了找到一种不需要高分子修饰的直接合成PtNPs的方法,来自苏黎世联邦理工学院化学与应用生物科学系的Helma Wennemers教授(点击查看介绍)及其同事对3375种短肽进行了筛选,找到了一类短肽可以辅助形成稳定、均匀的PtNPs,同时这种PtNPs具有肝癌细胞特异性的细胞毒性,只对HCC细胞有显著的细胞毒性,而对正常肝细胞及其他癌细胞系无明显细胞毒性,这表明这种短肽修饰的PtNPs是一种疗效佳、系统毒性低的特异性肝癌药物。相关研究成果于近日发表在Angew. Chem. Int. Ed. 上,并被选为封面文章。

当期封面。图片来源:Angew. Chem. Int. Ed.
为了在水中制备出稳定的PtNPs,作者对3375种短肽进行了筛选,他们将这些短肽和K2PtCl4一起孵育,并加入硼氢化钠还原,观察是否形成棕色或者黑色的PtNPs。经过实验,作者找到了几种具有H-Lys-Pro-Gly-dLys-NH2(1)这一序列的短肽可以形成PtNPs。作者随后合成了短肽1以进一步优化颗粒的合成方法,最终找到了一种可以合成均匀的、粒径为1.9±0.8 nm的PtNPs的条件,这些PtNPs可以在反应液中稳定存在数月,但是一旦透析就会团聚在一起。因此作者对1的一系列同系物进行了构效关系(SAR)分析,找出了可以形成稳定PtNPs的短肽的特点:N端必须要有赖氨酸的氨基残基;C端的羧基必须被反应掉;两个赖氨酸残基之间需间隔2个氨基酸;主链α-C原子的构象影响不大;脯氨酸(Pro)和甘氨酸(Gly)可以被替换。因此作者最终选择了七肽(2):H-Lys-[Pro-Gly-Lys]2-NH2。这种多肽修饰的PtNPs(PtNPs-2)的粒径为2.5±0.7 nm,透析纯化之后不会团聚,可以保存1年以上,反复的冻干复溶之后粒径也无明显变化。
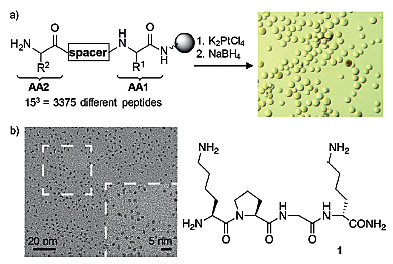
短肽的筛选方法及PtNP-1的TEM表征。图片来源:Angew. Chem. Int. Ed.
接下来作者利用MTT研究了PtNPs-2对肝细胞癌细胞(HepG2)以及几种其他的癌细胞系(结肠癌、乳腺癌、宫颈癌、前列腺癌、上皮细胞癌、肺癌、卵巢癌)的细胞毒性。结果显示PtNPs-2对HepG2有较高的细胞毒性,其半抑制浓度IC50 = 2.9±0.3 mg/L,最大的抑制率高达79%,但是其对其他的细胞系没有明显的细胞毒性。这些结果表明这种多肽修饰的PtNPs对肝细胞癌具有特异性的细胞毒性。
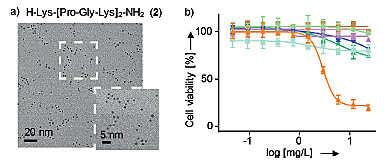
PtNPs的TEM表征及对不同细胞系的细胞毒性。图片来源:Angew. Chem. Int. Ed.
由于癌细胞的葡萄糖代谢水平较高,细胞表面的葡糖糖转运体数量较多,因此作者对短肽2进行了葡萄糖修饰得到了多肽2a,这种多肽同样可以形成稳定均匀的PtNPs(PtNPs-2a)。细胞毒性实验发现PtNPs-2a对HepG2的细胞毒性更高(最大抑制效率为97%,IC50 = 2.4±0.6 mg/L),这种颗粒同样不会杀伤其他癌细胞。通过与顺铂和索拉菲尼进行比较,作者发现PtNPs-2a对HepG2的细胞毒性与索拉菲尼相当,且显著强于顺铂。索拉菲尼和顺铂对结肠癌细胞系HT-29也有较大的细胞毒性,但是PtNPs对HT-29的细胞毒性却很低。这表明这种PtNPs只会对肝癌细胞系产生较大的细胞毒性。在非癌变的小鼠肝细胞上进行的实验结果也相似,PtNPs基本不会杀伤肝细胞,而顺铂和索拉菲尼却对正常肝细胞具有很大的细胞毒性。这些结果表明尽管PtNPs对肝癌细胞系的细胞毒性较大,但是却不会杀伤正常肝细胞和其他类型的癌细胞,因此PtNPs对肝癌细胞具有很强的特异性。
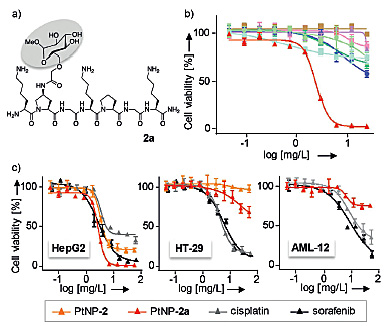
短肽2a修饰的PtNPs及其他药物对不同细胞系的细胞毒性。图片来源:Angew. Chem. Int. Ed.
最后作者对这一现象的原因进行了分析。对细胞内的Pt进行定量分析发现HepG2和HT-29摄取顺铂的能力相当,而摄取PtNPs的能力都显著强于摄取顺铂的能力(20倍以上),HepG2摄取PtNPs-2a的量是HT-29的两倍。对细胞核中的Pt的定量分析显示70%的Pt在HepG2的细胞核中,而只有25%的Pt位于HT-29的细胞核中。这些结果表明决定PtNPs细胞毒性的因素不仅仅包括细胞摄取的颗粒的量,还包括细胞内的氧化状态,且后者的影响更大。
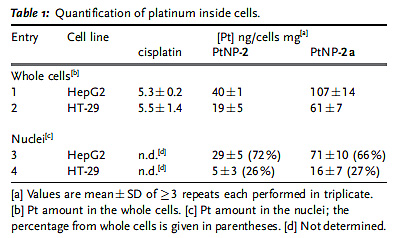
细胞内及细胞核内的Pt定量。图片来源:Angew. Chem. Int. Ed.
总而言之,本研究通过高通量的筛选,找到了一类可以形成尺寸较小且均匀的PtNPs的短肽1,通过构效关系分析后找到了短肽2可以形成更稳定的PtNPs-2,而对2进行葡萄糖修饰的2a可以得到对肝癌细胞毒性更大的PtNPs-2a。细胞毒性实验显示PtNPs-2和PtNPs-2a都只特异性地杀伤肝癌细胞系,其细胞毒性与索拉菲尼相当,且高于顺铂;同时对其他癌细胞系基本无细胞毒性。更令人欣喜的是,这两种PtNPs对正常的肝细胞也无明显的细胞毒性,而较高的细胞摄取量和肝癌细胞内的特殊氧化环境是造成这种现象的原因。这是目前为止发现的对肝癌细胞系选择性最高、细胞毒性最高的药物,有助于指导未来开发肝细胞癌特异性的抗癌药物。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Peptide-Coated Platinum Nanoparticles with Selective Toxicity against Liver Cancer Cells
Angew. Chem. Int. Ed., 2019, 58, 4901-4905, DOI: 10.1002/anie.201813149
导师介绍
Helma Wennemers
https://www.x-mol.com/university/faculty/2790
(本文由瀚海供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






















































 京公网安备 11010802027423号
京公网安备 11010802027423号