胰岛素受体调控基因表达的新方式
本文获“BioArt”授权转载,版权归“BioArt”所有,任何转载需获得“BioArt”授权。
近些年来,研究人员发现,一些受体酪氨酸激酶(receptor tyrosine kinase, RTK)能够出现在细胞核内,可能参与某些基因表达调控,但是具体的分子机制,还未研究清楚【1】。作为一种受体酪氨酸激酶,胰岛素受体(Insulin receptor, IR)同样被发现存在于细胞核内,但它在细胞核内的功能同样没有研究清楚。
胰岛素受体的经典信号通路起始于其与胰岛素的结合,之后,胰岛素受体自磷酸化,然后激活一系列激酶,包括PI3K-AKT信号通路。而PI3K-AKT信号通路则通过对多个下游靶蛋白的激活,调控了葡萄糖转运、糖原合成以及蛋白质翻译等细胞生理活动【2】。这个信号通路的激活是一个快速的反应,AKT也能通过磷酸化转录因子FOXO1调控一些基因的表达,从而实现一些长期的(long-term)细胞生理活性调控,比如对糖代谢的调控就是通过转录因子FOXO1来实现的【3】。然而,胰岛素受体对机体的长期调控并不仅限于目前的研究,其他更主要的模式机制还未研究清楚。
来自哈佛医学院的John G. Flanagan教授团队于2019年4月4日在 Cell 期刊在线发表了题为Insulin Receptor Associates with Promoters Genome-wide and Regulates Gene Expression的研究论文。他们发现,胰岛素受体能够在细胞核内结合到许多基因的启动子区,调控这些基因的表达。胰岛素受体调控的靶基因,大多数都与胰岛素相关的一些功能有关。胰岛素受体对这些基因的调控,受到胰岛素与其受体结合的影响。

本研究首先利用免疫共沉淀(immunoprecipitation)和质谱(mass spectrometry)技术鉴定与胰岛素受体存在相互作用的蛋白,结果显示RNA聚合酶Ⅱ(RNA polymerase Ⅱ, Pol Ⅱ)与胰岛素受体之间存在相互作用。另外,胰岛素受体的入核是通过分子伴侣蛋白HSP70来实现的,这与EGFR蛋白的入核机制非常相似。
接下来,通过CHIP-seq实验发现,胰岛素受体在细胞核内主要定位于转录起始位点(transcription start site, TSS)附近,与胰岛素受体结合的基因位点主要与基因的转录激活相关,比如H3K4me3和H3K27ac位置附近,说明胰岛素受体对基因的调控可能是通过激活基因的表达来实现的,而不是通过对基因表达的抑制作用。进一步的分析发现,胰岛素受体的靶基因主要涉及到胰岛素调控的一些生理功能,比如脂肪的合成和储存、蛋白质合成、免疫以及转录等,而涉及到的疾病也是与胰岛素相关,包括糖尿病、癌症和神经退行性疾病等,如图1所示。
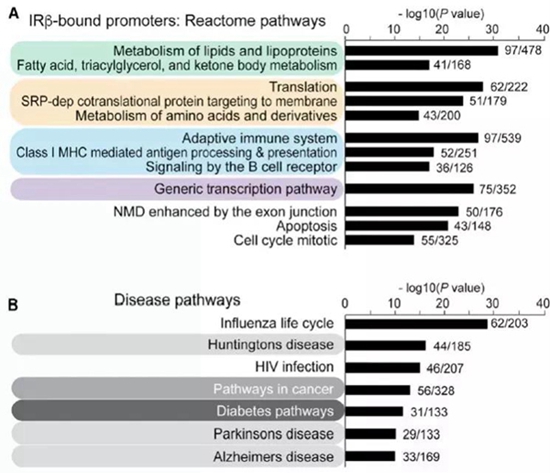
图1 胰岛素受体调控的基因
紧接着,研究人员测试了胰岛素对于胰岛素受体在细胞核内作用的影响,发现胰岛素能够促进胰岛素受体与基因组的结合,促进RNA聚合酶Ⅱ的招募,并促进相关基因的表达。另外,胰岛素受体对基因的调控作用具有细胞特异性,在肝癌细胞系HepG2中,胰岛素受体激活的基因主要与脂肪代谢相关,这是肝脏组织的功能特异性,而在神经细胞系SH-SY5Y中,胰岛素受体激活的基因则与囊泡转运和RNA剪切等神经组织特异性功能相关。
因为没有找到与胰岛素受体特异性结合的DNA序列,所以研究人员通过亲和纯化以及质谱等技术找到了胰岛素受体的另外一个结合蛋白,HCF-1(Host Cell Factor-1),它能促进胰岛素受体与基因组启动子区的结合,是胰岛素受体调控基因转录的辅助蛋白。一些与HCF-1结合并功能相关的转录因子,如OGT、THAP11、YY1、GABPA和ZNF143等也被证实能够结合到胰岛素受体结合的基因启动子区,而胰岛素受体调控的基因功能也被证实需要HCF-1的作用。
本研究还发现一个有趣的现象,即胰岛素受体激活的基因主要与脂代谢相关,相反,与糖代谢相关的一些基因并没有被胰岛素受体激活。
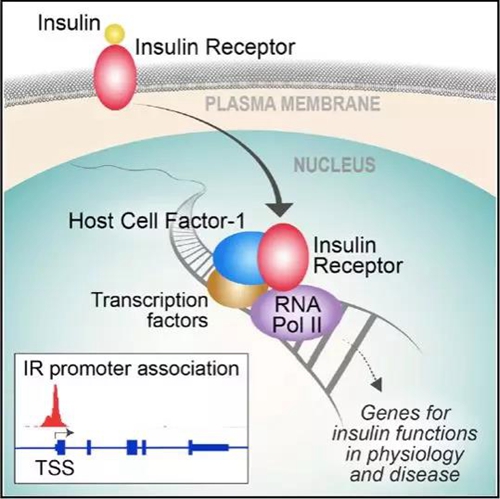
图2 胰岛素受体调控基因表达机制
总之,本研究发现,胰岛素受体(IR)能够与HCF-1等蛋白组成复合体,定位于细胞核内一些基因的启动子区,激活这些基因的表达。胰岛素受体对基因的这种调控方式,受到胰岛素的影响,是胰岛素调控细胞生理活动的一种长程反应方式。本研究对于理解糖尿病、癌症和神经退行性疾病等提供了一种新的思路,为治疗这些代谢相关疾病发展了一种潜在的策略。
原文链接:
https://doi.org/10.1016/j.cell.2019.02.030
参考文献
1 Carpenter, G., and Liao, H.J. (2013). Receptor tyrosine kinases in the nucleus. Cold Spring Harb.Perspect. Biol. 5, a008979
2 Boucher, J., Kleinridders, A., and Kahn, C.R. (2014). Insulin receptor signaling in normal and insulin-resistant states. Cold Spring Harb. Perspect. Biol. 6. Published online January 1, 2014. https://doi.org/10.1101/cshperspect. a009191.
3 Kang, S., Tsai, L.T., and Rosen, E.D. (2016). Nuclear Mechanisms of Insulin Resistance. Trends Cell Biol. 26, 341–351

如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号