专家点评Nature背靠背 |浙大教授解释基因敲除为何没有表型
本文获“BioArt”授权转载,版权归“BioArt”所有,任何转载需获得“BioArt”授权。
核心提示:两篇背靠背发表的Nature文章的核心机制为何是矛盾的?详见文末专家点评解释。
Robustness指一个复杂系统适应和应对内部和外界扰断而行使正常功能的能力。遗传系统健壮性(genetic robustness)指一个生命体能缓冲基因组中有害突变的能力。突变是生命进化的原动力,而有害突变是致死。一个稳定的遗传系统既能缓冲突变同时进行世代更迭,这样本体能维持正常功能,突变在代际间传递和累积给予了生物系统进化发展的空间【1】。遗传稳定性可由多种机制介导:1. 遗传冗余基因(genetic redundancy)可替代失活基因行使正常功能;2. 遗传网络的重整(rewiring genetic network)也可以应对变化/扰动;3. 酵母中发现了适应突变(adaptive mutations: 相应突变来应对致死突变而得以生存)【2】。
2015年,德国马普学会Didier Stainier教授报道斑马鱼中一种遗传补偿效应(genetic compensation)【2】。斑马鱼中,科学家使用Morpholino来阻断mRNA翻译进行基因功能缺失的研究。Stainier教授用Morpholino阻断基因egfl7的翻译,观察到血管网络系统异常。而当他们检测egfl7基因的一种缺失突变时,该突变体却一切正常没有与Morpholino实验相似的表型!进一步实验表明该缺失突变体中egfl7基因RNA水平极低,但与之功能相似并序列同源的emilin系列基因表达上升,出现了转录水平的适应(adaption)反应,这些基因的表达补偿了egfl7功能的缺失。遗传补偿效应只在这种缺失突变体观察到(图1)。显性失活(dominant negative)突变体、morpholino处理,以及CRISPR技术阻断转录延长实验均不能进行遗传补偿。在多个基因,在老鼠和拟南芥中均发现了这种现象,表明遗传补偿是一种普遍的现象,但分子机制不清楚。
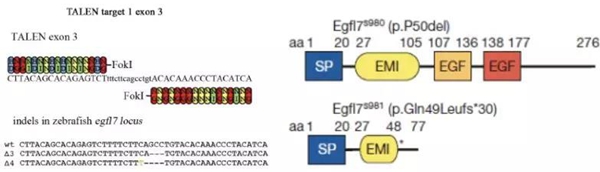
图1 TALEN造成egfl基因第三个外显子3/4bp的缺失,形成了egfl7mRNA在氨基酸第49位提前终止密码子。
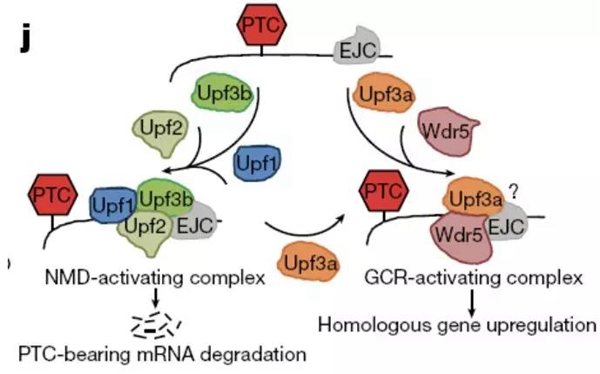
2019年4月4日,Nature背靠背在线发表了浙江大学陈军教授和Stainier教授的研究成果,揭示了遗传补偿效应的分子机制。研究表明这些没有表型的基因突变均可转录产生无义mRNA,无义mRNA引起相应降解(non-sense mRNA mediated decay,NMD)。介导NMD的Upf3a蛋白可以和COMPASS复合物直接作用,激活同源基因的表达,进行功能补偿。这是首次发现基因突变产生的无义mRNA降解直接介导对同源基因位点进行表观遗传调控,激活其表达。


这一分子机制的阐明将有助于我们理解遗传操作实验的一些看似相悖的结果,同时提供一种全新的思路解释和治疗人类的某些遗传病(见专家点评)。陈军教授的研究在斑马鱼中完成,Stainier教授同时进行了斑马鱼和老鼠的实验。下面将主要解读陈军教授的实验。
斑马鱼中,Morpholino抑制capn3a基因功能造成肝脏缩小,而capn3a一个14bp缺失突变体(Δ14)却表型正常。该缺失突变体造成氨基酸第60位沉默突变即一个提前终止密码子,capn3mRNA水平也非常低,显示是一个完全功能缺失突变。作者同时检测19个capn3同源基因发现有共计10个同源基因的mRNA水平升高,capn8和capn12的表达增加最多(图2),但是Morpholino组没有这些基因表达升高。作者推测是无义mRNA降解(NMD)引起的。为了验证推测,作者继续构建了多个capn3基因不同位点的沉默突变,可能引起NMD。实验表明,不同位点的沉默突变可有不同的补偿效果。有75%位点的沉默突变没有肝脏缩小表型,激活了同源基因的表达。这一补偿效应有序列特异性,只引起同源基因的表达升高。capn3无义RNA不能引起别的基因的表达上升。同时capn3a转录本水平越低,同源基因的表达越高。进一步分析显示,补偿效应的产生需要这些无义RNA的转录和翻译,进一步提示了NMD的存在。
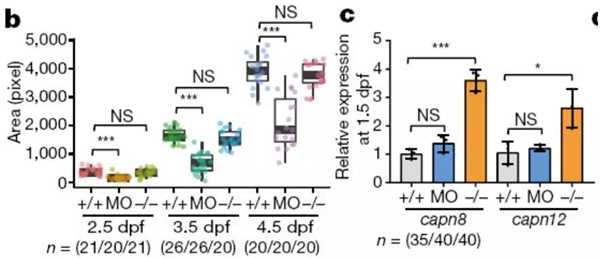
图2capn3a缺失突变的无义RNA降解造成capn8和capn12基因表达升高,进行遗传补偿。
无义mRNA降解(NMD)由Upf1,Upf2和Upf3蛋白结合在外显子连接部位,触发RNA降解。Upf3b活跃参加介导了NMD,而在其他研究中upf3a没有NMD作用,甚至显示相反效果。本文构建了upf3a(-);capn3a(Δ14)双缺失突变体,斑马鱼呈现了capn3a功能缺失的肝脏缩小表型,没有了遗传补偿,揭示了upf3a介导了遗传补偿效应。
COMPASS复合物(complex of proteins associated with Set1)可对转录起始位点(TSS)进行组蛋白H3K4的三甲基化,激活基因转录起始。upf3amorpholino对capn3a(Δ14)胚胎处理后,可见在capn8和capn12基因TSS位点组蛋白H3K4的三甲基化水平的降低。Upf3a蛋白可和COMPASS复合物Wdr5蛋白直接作用,并和Rbbp5蛋白发生联系,形成Upf3a-Wdr5-Rbbp5的复合物,激活基因转录。Morpholino阻断wdr5功能,可抑制遗传补偿效应,表明COMPASS复合物在遗传补偿作用中是必需的。
Stainier教授文中还提到了一个有趣的现象,转染相应基因的短RNA片段同样可以上调该基因的表达。更近一步,降低基因反义RNA(antisense transcript)具有相同的效果。这预示着基因转录可以同时影响基因表观遗传水平的调控。
结上述研究成果,基因缺失突变形成的无义mRNA降解NMD可引导COMPASS复合物对同源基因的转录起始位点H3K4的三甲基化,激活同源基因转录。无义mRNA怎么介导对同源基因转录的表观调控,具体机制是什么,有待于下一步的工作。
原文链接:
https://www.nature.com/articles/s41586-019-1057-y
https://www.nature.com/articles/s41586-019-1064-z
参考文献
1. Kitano, H. Biological robustness,Nature Reviews Genetics, 5:827 (2004)
2. Rossi, A. et al. Genetic compensation induced by deleterious mutations but not gene knockdowns.Nature,524:230 (2015).
专家点评
孙永华(国家斑马鱼资源中心主任)
遗传补偿是指机体中特定基因发生功能丧失型的序列突变后,导致该基因家族的其他成员表达上调,从而弥补特定基因功能的遗传学现象。遗传补偿现象广泛存在于动植物,如拟南芥、斑马鱼、小鼠甚至是人类中,被认为是生物在进化中为了应对基因突变而产生的遗传耐受,其通常发生于基因敲除而非基因敲降个体中。近年来,随着基因组编辑技术的迅速发展,利用反向遗传学手段系统构建突变体研究基因的在体功能成为可能,然而出乎意料的是众多基因的突变并不会导致明显的表型缺陷。例如,在斑马鱼中,超过80%的基因突变并不会出现明显的表型。因此,学术界对遗传补偿的关注度越来越高。这两篇发表于Nature的论文利用斑马鱼或小鼠培养细胞模型,在不同的层面阐释了诱发遗传补偿效应的可能的分子机制。
德国马普研究所Didier Y. R. Stainier实验室详细论证了无义介导的mRNA降解(nonsense-mediated mRNA decay,NMD)对诱发遗传补偿的重要性:干扰NMD途径的重要因子upf1的表达会降低遗传补偿效应;在野生型胚胎中过表达未加冒的RNA(这种RNA在体内会快速被5’-3’核酸内切酶降解)会导致遗传补偿效应的出现;缺失基因的启动子区或整个基因座位(没有突变mRNA的降解)并不会导致遗传补偿效应。同时,他们的研究发现发生补偿的基因通常与突变mRNA具有高度的序列相似性,且补偿基因的高表达与其转录起始位点处的组蛋白H3K4me3修饰有关。
更进一步,浙江大学陈军实验室和彭金荣实验室合作发现,当且仅当转录的mRNA携带提前终止密码子(premature termination codon,PTC)才会诱导遗传补偿效应,如果突变位点位于基因的最后一个外显子则不会诱发遗传补偿,非常有意思的是他们还证明只有携带PTC和同源序列的转基因才能激活体内同源基因的表达,而注射体外合成的mRNA并不具备这样的功能。他们的研究进一步发现,介导NMD的upf1或upf3b都不参与遗传补偿效应的产生,而同家族的upf3a直接参与诱导遗传补偿效应:Upf3a蛋白结合在携带PTC的无义mRNA上,招募Wdr5-COMPASS复合体至同源基因的转录起始区域,促进核小体H3K4位的3甲基化,激活同源基因的表达,从而产生遗传补偿。如果无义mRNA与Upf3b结合,则会招募Upf2和Upf1使无义mRNA进入NMD途径。
这两份工作分别从NMD发生和无义 mRNA产生的角度,揭示了遗传补偿效应发生的可能分子机制。它们的共同点在于:1) 均强调无义mRNA对于遗传补偿发生的必要性;2)发生补偿的基因通常与突变RNA具有序列相似性;3)补偿基因的激活表达与其转录起始序列处的H3K4me3修饰相关。不同点在于,浙大工作认为无义突变mRNA并非只是简单地被NMD途径降解,部分无义突变mRNA会与Upf3a招募COMPASS复合体,激活同源基因的表达。
遗传补偿的分子机制的揭示对于如何阻断遗传补偿以研究基因功能,或者激活遗传补偿以实现对突变导致的遗传疾病的治疗均提供了全新的思路。例如为了更好地研究基因功能,通过敲除启动子区阻断突变RNA转录,或针对编码重要功能域的最后一个外显子创造突变,都可以有效地避免遗传补偿效应;另一方面,通过敲除/敲降upf3a也可以阻断遗传补偿等。对于错义突变所导致的遗传疾病的治疗,则可以考虑在突变基因中人为制造PTC或转基因引入PTC来诱发机体产生遗传补偿,从而达到基因治疗的目的。
总之,遗传补偿分子机制的发现具有重大科学意义。当然,这一领域仍然有一些亟待回答的科学问题。例如,在同一基因家族的多个成员间,发生遗传补偿是否具有基因或序列特异的选择性?为什么有些无义mRNA突变会导致遗传补偿,另一些突变又不导致补偿效应?是否存在过度遗传补偿,以及什么情况下可能出现过度补偿的效应?
专家点评
徐鹏飞(浙江大学医学院,百人计划研究员)
对于一些尚没有胚胎干细胞(ESCs)系的模式生物如斑马鱼等来说,利用同源重组的方法建立基因敲除模型一直是一项困难的任务,因此Morpholino(是把核苷酸上的五碳糖环用一个吗菲林(morpholino)取代,同时对磷酸基团也做了改变,使其可以以碱基配对的方式与体内的目的基因mRNA 结合,抑制蛋白翻译,达到瞬时敲低基因表达的目的,在斑马鱼、爪蟾和鸡胚等模式生物中得到广泛应用)等基因敲低技术一直是一种简便快捷的研究基因功能的手段,直到TALEN、Crispr-Cas9等基因编辑技术的出现,人们终于可以在斑马鱼等模式生物中高效的实现基因敲除,建立小鼠基因敲除模型的效率也大大提高了。大家在为之兴奋的同时,很多实验室(尤其是斑马鱼实验室)都多多少少遇到了相同的问题:基因敲除模型与Morpholino敲低模型不一致,甚至敲低表型在基因敲除模型中彻底消失。这个问题造成了很大的困扰:这种现象是因为Morpholino的脱靶效应引起的?难道之前很多的基因敲低工作都是错的?抑或是在遗传水平上完全缺失某些基因启动了全新的机制所导致?
针对这些问题,科学家们进行了深入的探索,之前已有一些工作表明遗传敲除某些基因会启动某种代偿机制,对缺失的基因,其同源基因会在突变体中的表达量上调,从而补偿其功能,而达到维持机体正常生理功能的目的【1,2】!但其机制并未阐明。
4月4日Nature在线背靠背发表的来自浙江大学生命科学学院的陈军老师和彭金荣老师实验室的工作,和来自德国马克普朗克研究所的Didier Stainier实验室的工作分别对其机制进行了研究【3,4】。陈军、彭金荣老师研究组首先针对capn3a和nid1a两个基因,用一系列漂亮的突变体结合转基因斑马鱼系证明了基因突变导致的遗传补偿机制(Genetic Compensation Response,GCR)是依赖于突变所造成的蛋白翻译未成熟提前终止信号(premature termination codon,PTC),这种提前终止会导致突变基因的同源基因上调,从而导致敲低capn3a导致的肝脏变小以及nid1a敲低所导致的体长变短两个表型在其各自的突变体中消失;进一步的研究证明该补偿机制依赖于Upf3a蛋白介导的一种存在于真核生物中重要的RNA监控机制- “无义介导的mRNA降解”信号通路(nonsense-mediated mRNA decay,NMD),但并不依赖于同样参与NMD的Upf1和Upf3b,有意思的是,Upf3a介导的基因代偿,并非使突变mRNA降解,相反的,是保护其不被降解(这与同期发表的另一篇文章的机制正好相反);陈、彭研究组进一步证明,Upf3a诱导遗传补偿的机制是其与COMPASS复合体结合,从而增加相关同源基因在转录起始位点附近的H3K4三甲基化水平,而最终使这些基因的转录水平上调(下图),而被保护的突变基因可能起到识别、并招募Upf3a及COMPASS复合体至其同源基因转录起始位点附近的作用。

同期背靠背发表的另一篇文章利用斑马鱼和小鼠模型,同样阐明了PTC介导的依赖于NMD的基因代偿机制,同样需要COMPASS介导的H3K4三甲基化参与,最大的不同是,Stainier组所阐述的机制依赖于突变mRNA的降解,而不是保护(下图),可能的原因是否是因为不同的组织所利用的遗传代偿机制有所不同?(前一篇文章两个基因分别影响肝脏和体长发育,后一篇文章主要关注了细胞的形态和斑马鱼血管)

综上所述,这两篇文章解决了困扰很多研究组的一个难题,为辛辛苦苦获得了突变体而发现表型没了的实验室重新带来了希望,因此相信一段时间内陈、彭老师的Upf3a突变体会非常抢手。另外,像这两篇文章中提到的,这也许可以为基因突变所导致的一些疾病带来新的治疗策略,同时,这两篇文章也引出了一些很有意思的问题,如:COMPASS在特定基因的突变体中如何实现特异性的识别其同源基因的,突变mRNA如何识别其同源基因的转录起始位点?是否有更多的表观遗传调控机制参与?以及为什么只有部分基因存在代偿机制,该代偿机制是否存在细胞或组织特异性等。
参考文献:
1.Rossi, A., et al., Genetic compensation induced by deleterious mutations but not gene knockdowns.Nature, 2015. 524(7564): p. 230-233.
2.Zhu, P., et al., Short body length phenotype is compensated by the upregulation of nidogen family members in a deleterious nid1a mutation of zebrafish.J Genet Genomics, 2017. 44(11): p. 553-556.
3.Zhipeng Ma1, P.Z., Hui Shi2,3, Liwei Guo1, Qinghe Zhang1, Yanan Chen1, Shuming Chen1, Zhe Zhang1, Jinrong Peng2* & and J. Chen1*, PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components.Nature.
4.Mohamed A. El-Brolosy1, Z.K., 8, Andrea Rossi1,4,8, Carsten Kuenne2, Stefan Günther2, Nana Fukuda1,, G.L.M.B. Khrievono Kikhi1, Carter M. Takacs3,5, Shih-Lei Lai1,6, Ryuichi Fukuda1, Claudia Gerri1,7,, and A.J.G.D.Y.R. Stainier1*, Genetic compensation triggered by mutant mRNA degradation.Nature.

如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号