Nature:“万能”的芳基C-H键区域选择性官能化
合成化学家的终极梦想,当然是随心所欲地编辑分子结构——想插入什么基团就能插入什么基团,想要什么样的立体结构就能得到什么样的立体结构。朝着这个目标,化学家已经取得了很多了不起的进步。举个例子,现在“圈粉无数”的直接C-H键官能化(Direct C–H functionalization)在某种程度上接近这种理想境界。但到目前为止,想要实现“想什么变什么”的区域选择性官能化还是需要借助导向基(氨基酸残基、杂环等)或者特殊的取代基(硼酸酯或卤素及其等价物等),否则会导致多种异构体的产生。然而,这些导向基的引入本身也会对后续官能化带来不兼容(比如高对位选择性的TEDAylation反应),或者取代基引入的区域选择性问题(如溴化和Ir催化C-H键硼酸酯化)。这些都大大限制了其应用潜力。
近日该领域迎来了最新突破,德国马克斯•普朗克煤炭研究所的Tobias Ritter(点击查看介绍)课题组在Nature 上报道了一种无需使用导向基便可高选择性实现芳基C-H键官能化的方法。反应通过噻蒽鎓盐(aryltetrafluorothianthrenium salts,Ar-TFT+)产生稳定的噻蒽阳离子自由基,进而与多种复杂的芳香烃形成双阳离子加合物,最终去质子化形成噻蒽化的产物,其区域选择性相比常规的溴化、硼酸酯化等过程大大提高。得到的产物还可进一步用于Suzuki偶联、Sonogashira偶联、Negishi偶联、Heck反应、羰基化、硼酸酯化、氯化、碘化、氰化等多种转化,堪称“万能”。

Tobias Ritter教授。图片来源:马克斯•普朗克煤炭研究所
早在上世纪70年代就有人发现噻蒽阳离子自由基和简单的富电子芳烃(如苯甲醚)可以发生反应,但可能由于使用的噻蒽鎓高氯酸盐对官能团兼容性差(如吡啶、氨基或羟基)、对水汽敏感及易爆炸,研究者并没有深入研究其选择性,也没有发掘其应用潜力。为了解决上述问题,Tobias Ritter教授课题组利用四氟噻蒽亚砜(试剂1)和催化量的四氟噻蒽(TFT,试剂2)在三氟乙酸酐和HBF4•OEt2的作用下原位形成四氟噻蒽鎓阳离子自由基(中间体I),I可以与富电子的苯胺衍生物和相对缺电子的二氯苯发生高区域选择性的C-H键噻蒽化反应,得到不同类型稳定的噻蒽鎓盐(固体状态可稳定放置数年),其溶解性很好(乙腈、二氯甲烷、DMF、DMSO和二氧六环等)。另外,对于富电性高于苯甲醚的芳烃(如30和31),反应需要使用非氟化的噻蒽和非氟化的噻蒽亚砜制备相应的噻蒽鎓阳离子自由基,否则会发生单电子自由基氧化而不能得到产物。但即使这样,吲哚也不能发生反应,除非修饰吸电子基团(如32)。含有硼酸的芳烃由于会出现芳环取代基本位的进攻(ipso-substitution)依然无法实现这一转化。尽管如此,这种方法相比以往的工作仍具有很大的进步,反应对大多数官能团可以很好地兼容,如氨基、酰胺、羟基、醚、酯基、羧酸和芳香杂环(噻唑、吡啶等)。羟基在该反应条件下虽然会发生三氟乙酰化,但在后处理时会发生水解;碱性基团由于可发生质子化,因此可避免氧化;酸敏感基团修饰的底物参与反应可以通过TMSOTf、BF3•OEt2来替换HBF4•OEt2。大部分底物参与反应都得到了超过99%的区域选择性,无一例外地优先选择富电子位点,其选择性取决于芳烃的电子特性。同时,底物的位阻对该反应没有明显的影响(如13),可能是由于所形成的C-S键键长较长。
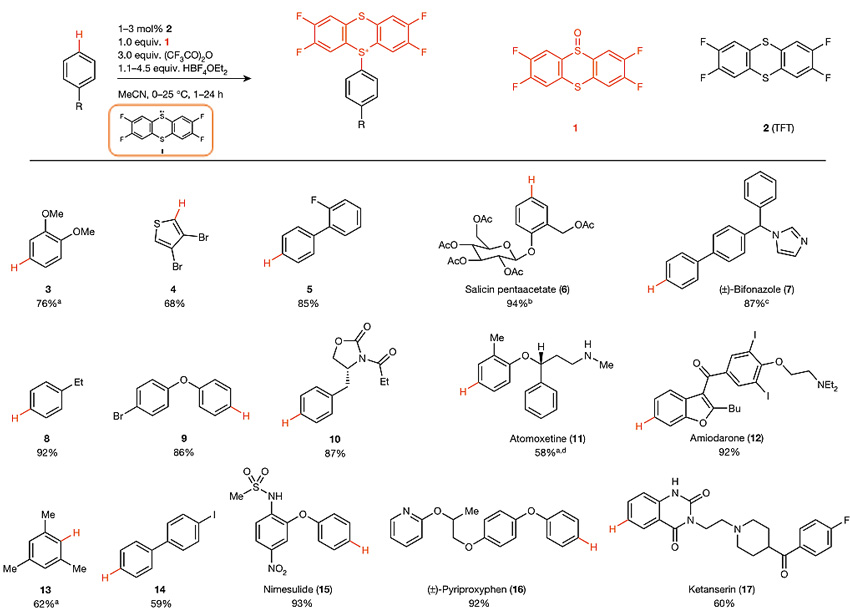
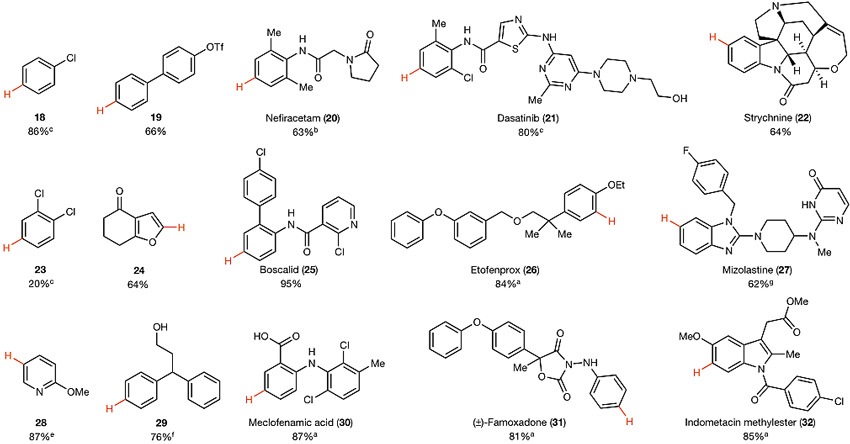
噻蒽化的底物适用范围。图片来源:Nature
更让人惊喜的还在后面。Ritter课题组的实验证明,这种四氟噻蒽鎓阳离子可以通过过渡金属催化或光氧化还原反应进行13种转化(也许不限于此),包括Heck反应、Negishi偶联、Suzuki偶联、Sonogashira偶联、Minisci C-H键活化、氰化、硼酸酯化、碘代、氯代等,甚至可实现一锅法合成(如49、52、53)。此外,四氟噻蒽鎓阳离子比溴化物和三氟甲磺酸酯发生氧化加成的速率更快,因此可以用在化学选择性的交叉偶联反应中。四氟噻蒽鎓阳离子能被光敏剂单电子还原为芳基自由基,可以实现在室温下的多种光氧化还原反应(如Minisci型反应、氰基化)。
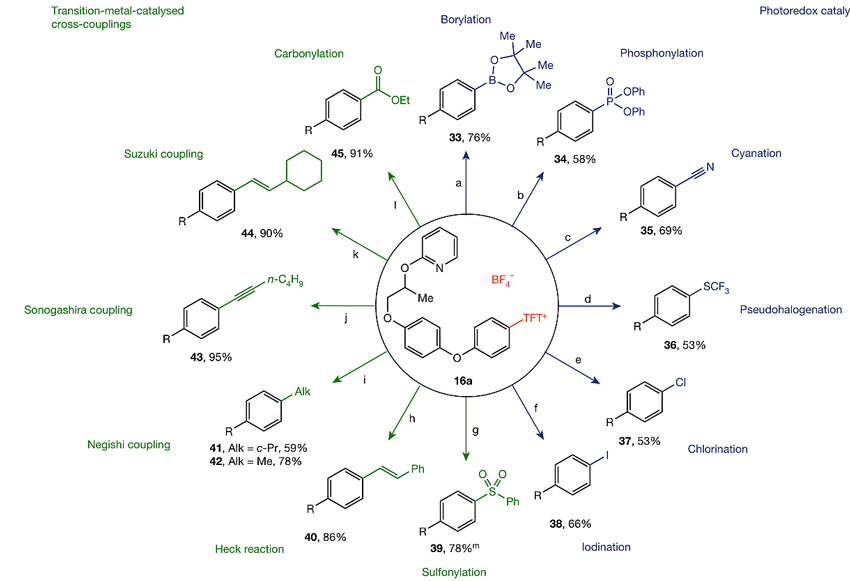
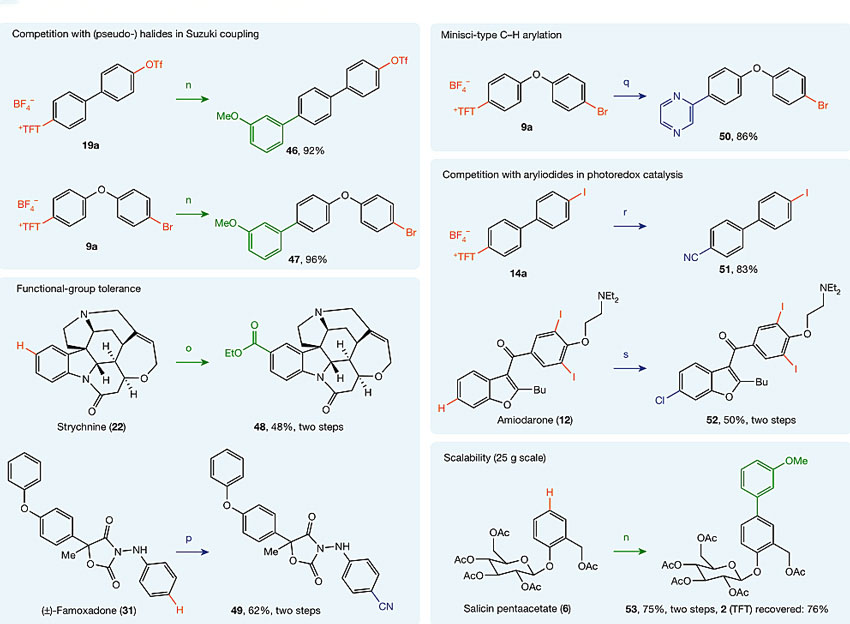
噻蒽化产物的应用。图片来源:Nature
作者认为该反应可分三步(下图a):(1)产生噻蒽鎓阳离子自由基I;(2)形成双阳离子加合物II;(3)不可逆地去质子化形成产物。电子顺磁共振谱分析表明,噻蒽鎓阳离子自由基I是通过亚砜1和噻蒽2的归中反应得到的(图4b)。另外,阳离子自由基I还能通过电化学氧化噻蒽2或者亚砜1在还原剂(溶剂或痕量杂质)的诱导下得到,芳烃存在下同样能达到与上述方法一样的选择性(下图c)。
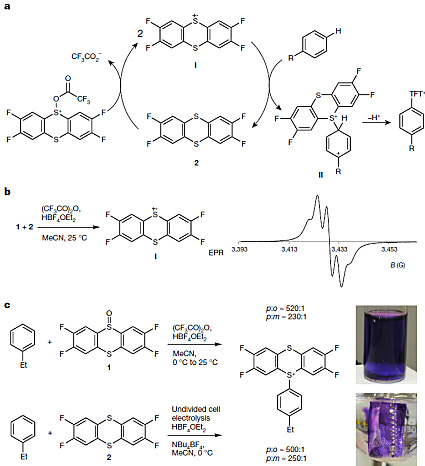
可能的机理和机理验证实验。图片来源:Nature
总结
化学领域的“老树开新花”不是什么新鲜事。比如,近年来对上世纪40年代的Nazarov反应对映选择性的研究就占据了顶级期刊很大篇幅(点击阅读相关);马大为教授也因为对1901年发现的Ullmann反应进行条件优化做出的贡献而获得2018年第三届未来科学大奖物质科学奖。Tobias Ritter教授重新挖掘40多年前噻蒽鎓盐在高区域选择性C-H键直接官能化方面的应用潜力,实现了无导向基团参与的芳基C-H键高选择性官能化。该反应相比以往的方法对区域选择性进行了大幅度的提升,而且还能实现复杂分子的选择性后期修饰,对于包括药化在内的多个领域实用意义巨大。同期Nature刊登了题为“Molecular-decoration technique offers boost to medicinal chemists”的评论 [1],称这项工作有可能改变“交叉偶联反应在有机合成中的战略用途”。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Site-selective and versatile aromatic C−H functionalization by thianthrenation
Nature, 2019, 567, 223, DOI: 10.1038/s41586-019-0982-0
导师介绍
Tobias Ritter
https://www.x-mol.com/university/faculty/50250
参考资料:
1. Molecular-decoration technique offers boost to medicinal chemists. Nature, 2019, 567, 184-185
https://www.nature.com/articles/d41586-019-00767-w
(本文由与谁同坐供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号