Nat. Chem.:拉伸一下,马来酰亚胺-巯基加合物更稳定
马来酰亚胺常常被用于和蛋白上的巯基偶联以实现对蛋白的位点选择性修饰,它们之间的迈克尔加成反应选择性高、快速,同时条件也温和。实际上,已经有多个FDA批准的抗体-药物缀合物是通过这类反应获得的。然而,加合物硫代琥珀酰亚胺也面临一些问题:新生成的C-S键在生理条件下稳定性不足,会发生逆迈克尔加成,在有竞争性的巯基化合物(例如半胱氨酸)时更不稳定。过去人们发现,硫代琥珀酰亚胺中酰亚胺的一个C-N键其实也可开环水解断裂,但这个键的断裂并不会破坏对蛋白质的化学修饰,C-N键断裂后,C-S键的稳定性反而会大大提高。
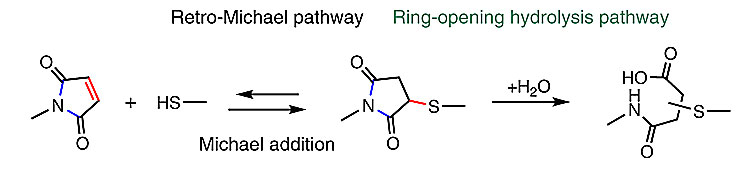
图1. 巯基和马来酰亚胺的加合物有两种可能反应路径。图片来源:Nat. Chem.
学有机化学的同学肯定有的是办法可以把酰亚胺水解掉,但这里还涉及脆弱而敏感的蛋白质,所以长久以来一直没有简单普适的办法可以提高加合物硫代琥珀酰亚胺的稳定性。近日,南京大学物理学院曹毅教授和王炜教授领导的团队通过单分子力谱和化学结构表征发现适当大小的机械力可以优先断裂C-N键,从而稳定C-S键,由此他们使用温和的超声对马来酰亚胺-巯基加合物施加机械力来制备稳定的聚合物-蛋白质缀合物。相关成果发表在近期的Nature Chemistry 上。
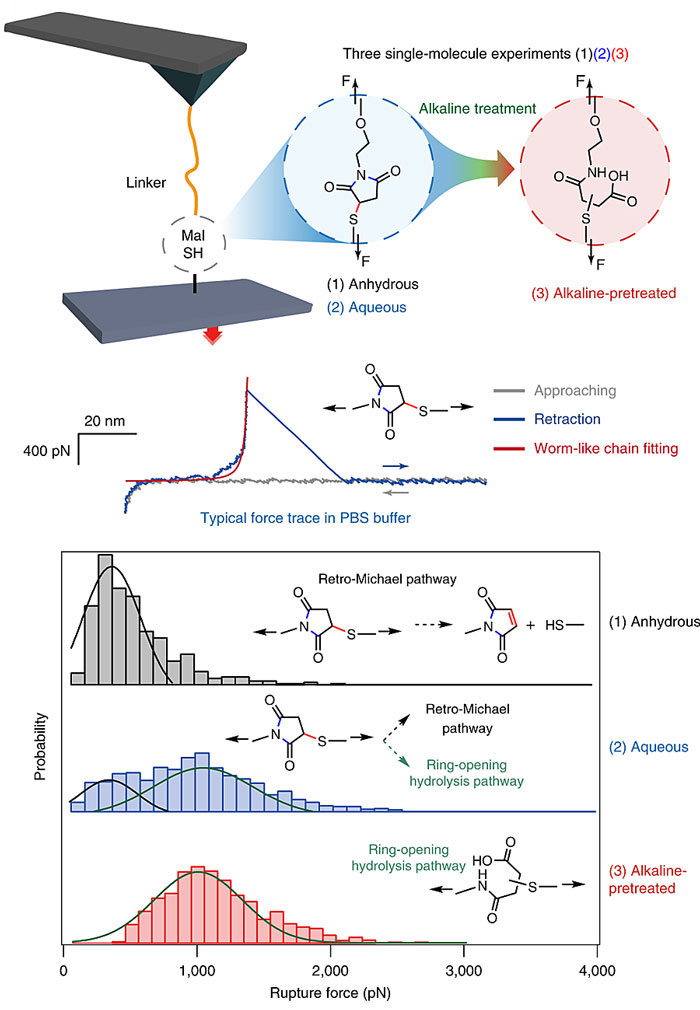
图2. 加合物在三种不同化学环境下的单分子力谱。图片来源:Nat. Chem.
研究人员首先通过单分子力谱研究在三种不同条件下硫代琥珀酰亚胺连接的聚合物在外力拉伸时的现象。在无水条件下,只需要390 pN的力就能让聚合物通过逆迈克尔加成发生断裂,而当实现用碱处理过后,拉断聚合物需要的力提升到了约1070 pN,说明酰亚胺的水解确实显著提高了C-S的键强。有趣的是,在水中拉伸聚合物时,断开聚合物需要的力分别对应于上述两种情况,说明确实力促使一部分硫代琥珀酰亚胺发生了水解,从而变得更稳定。
于是研究人员尝试先将聚合物在一定的拉力下拉伸一定时间,再测量拉断聚合物所需要的力。测量结果表明,对聚合物进行预拉伸确实会提高拉断聚合物所需要的力,并且在一定范围内和预拉伸的力的大小以及预拉伸的时间正相关。
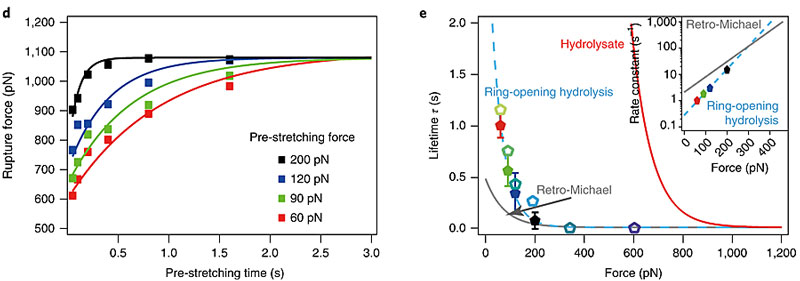
图3. 预拉伸改变了稳定性。图片来源:Nat. Chem.
为了验证这种改变确实是因为预拉伸的力水解了酰亚胺键,研究人员合成了一些模型化合物,并通过红外光谱和核磁共振等手段对施加外力前后的化合物进行表征。红外光谱显示,聚合物P1在经过超声处理(产物为UP1)或者碱水解后(产物为AP1),都会在1650 cm-1处出现一个新的峰。因为AP1和UP1的NMR特征峰和PEG重叠,无法用NMR确认酰亚胺的水解,作者又设计了另一个模型聚合物P2。碱性水解后的AP1中,P1中苯环上的H的化学位移分别向高场和低场移动;在超声处理的UP2中,可以看到大约75%的酰亚胺发生了开环,同时由于一个分子上的两个酰亚胺环可能以两种不同方式开环,所以导致核磁信号出现裂分。
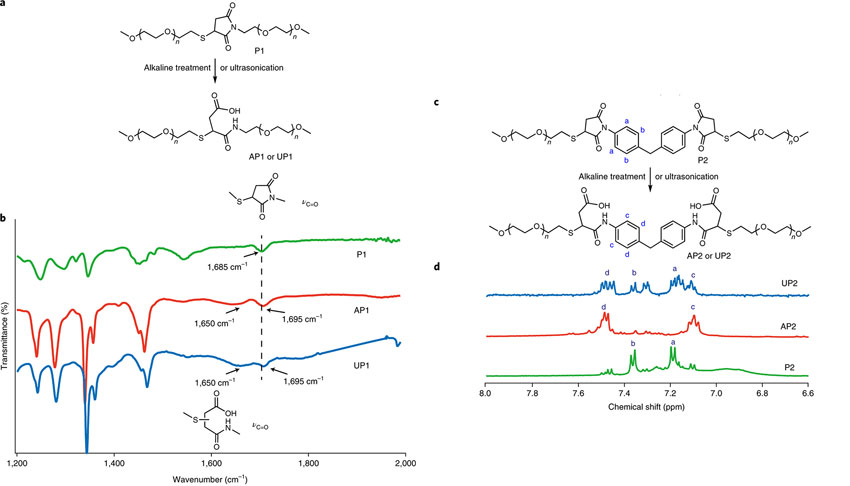
图4. 红外光谱和核磁表明超声和碱处理一样导致酰亚胺键的水解。图片来源:Nat. Chem.
最后,研究人员展示了这种力化学提高加合物稳定性的理念在生物医药领域的应用潜力。为此,研究人员选择用超声而不是机械力,来打开酰亚胺环,因为超声能够直接作用于溶液样品。结果表明,超声处理并纯化的后的抗体-PEG缀合物表现出和未经超声处理的对照组相似的活性,并且稳定性更好——一周后未超声处理的有效浓度下降了50%,而超声处理的仅下降了10%。
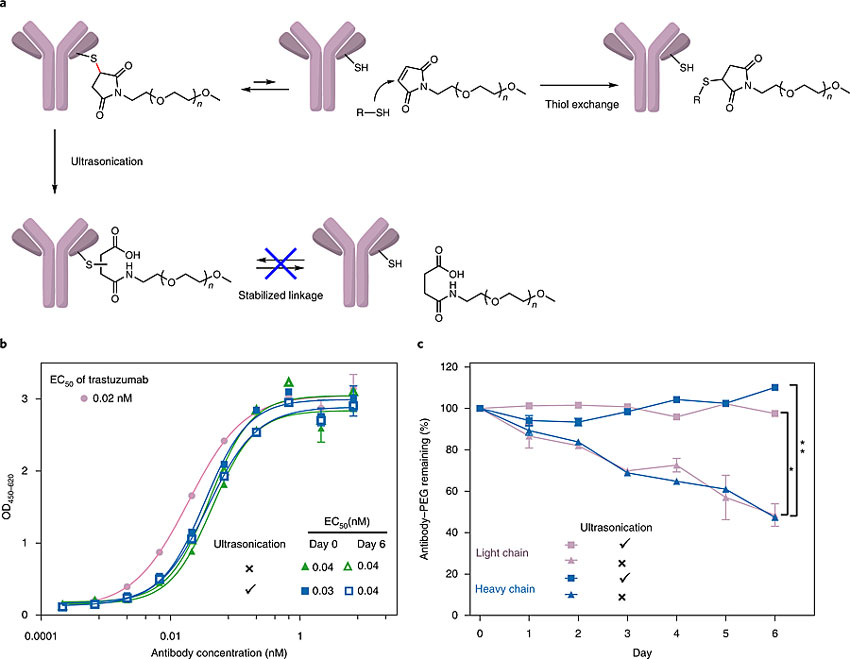
图5. 超声处理提高基于马来酰亚胺-巯基加合物的抗体-PEG缀合物稳定性。图片来源:Nat. Chem.
以上,研究人员发现机械力能让硫代琥珀酰亚胺的反应路径发生改变,优先发生开环水解反应,避免了逆迈克尔加成反应的发生,从而提高蛋白质和修饰分子连接的稳定性。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Maleimide-thiol adducts stabilized through stretching
Nat. Chem., 2019, 11, 310–319, DOI: 10.1038/s41557-018-0209-2
(本文由荷塘月供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






















































 京公网安备 11010802027423号
京公网安备 11010802027423号