Science:挑战[4+1]环加成?要用“双核”镍催化剂
碳环(包括碳杂环)化合物在自然界的生命活动中扮演了重要角色,比如作为能量来源的糖类、细胞复制的原料碱基、调节代谢的甾体类激素等等。另外,从人类赖以生存的外部环境看,衣食住行医大多会涉及来自石油化工领域的碳环化合物。碳环的构建向来是合成化学家钟情研究的领域。Diels-Alder反应、Nazarov环化反应、Robinson成环反应、关环复分解(ring closing metathesis,RCM)反应、Simmons-Smith反应以及各类杂环(吡啶、吡咯、噻吩、呋喃、黄酮、喹啉等)合成的反应,丰富了[4+2]、[3+2]、[2+2+1]和[2+1]等成环的方法学。然而,[4+1]类反应鲜有报道,实现这个反应必然要使用到1,3-丁二烯和高活性的C1物种,C1物种通常是卡宾。但是从量子力学的角度来讲,卡宾(单线态的亚甲基)的孤对电子会与丁二烯上填满的φ1轨道产生闭壳排斥作用(closed-shell repulsion),从而导致反应趋向于能量更优的[2+1]环化而生成烯基环丙烷。既然这种协同机制不可实现,那么分步策略,即先生成烯基环丙烷后发生1,3-重排形成烯基环戊烯是否可行?遗憾的是,科学家经过大量研究发现,这种重排的活化能高达50 kcal/mol,需要超过300 ℃的高温才能实现。
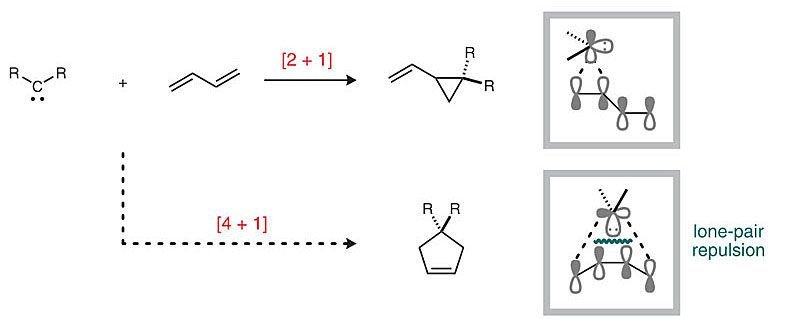
图1. 卡宾与1,3-丁二烯发生[4+1]反应是电子禁阻的。图片来源:Science
但是这种分步合成环戊烯的方式并非没有可取之处,在合适的C1物种和催化体系下转化可能会加速进行。近日,美国普渡大学的Christopher Uyeda(点击查看介绍)课题组实现了双核镍催化剂催化亚乙烯基卡宾和1,3-丁二烯的[4+1]环加成,该方法通过1,1-二氯烯烃在锌粉条件下还原形成C1合成子亚乙烯基卡宾,对分子间及分子内的反应均适用。反应在C2对称的手性配体下可以高选择性地诱导分子内的环加成反应。相关工作发表在Science 上,第一作者为You-Yun Zhou博士。

图2. You-Yun Zhou博士(左)与Christopher Uyeda教授(右)。图片来源:Purdue University
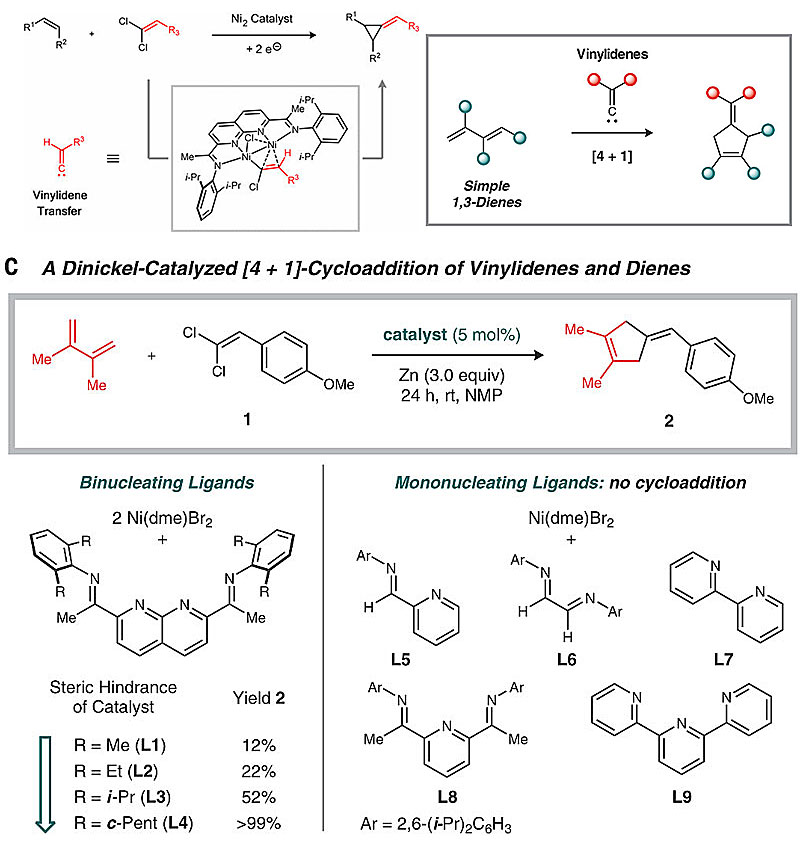
图3. 双核镍催化亚乙烯基卡宾和丁二烯的[4+1]环加成反应。图片来源:Science
该研究的灵感来自于之前他们完成的一项工作:1,1-二氯乙烯被锌粉还原成活性的亚乙烯基镍化合物Ni2(C=CHR)后,在双核镍催化剂[ iPrNDI]Ni2(C6H6)作用下与烯烃发生[2+1]反应生成亚甲基环丙烷化合物,值得注意的是,这个转化机理是分步的。因此,Uyeda等人设想如果将简单烯烃换成1,3-丁二烯或许有可能通过分步反应实现形式上的[4+1]环加成构筑环戊烯类化合物。经过一系列的催化剂筛选,他们最终发现只有在双核催化体系(2 Ni(dme)Br2 + L4)中才能实现高效转化,体系中未出现[2+1]环加成的副产物,也没有出现产物异构化的现象,而单核催化体系(Ni(dme)Br2 + L5-L9)均不反应。更有意思的是,生成的烯基环戊烯产物不会发生环外双键异构化。
随后,研究人员在优化的反应条件下进行底物适用范围的考察。带有多种官能团如硝基、硫醚、环氧基、三氟甲基、氰基、酯基和硼酸酯的1,1-二氯烯烃底物都能与体系兼容,未取代的1,3-丁二烯或最简单的二氯乙烯也能很好地实现转化。
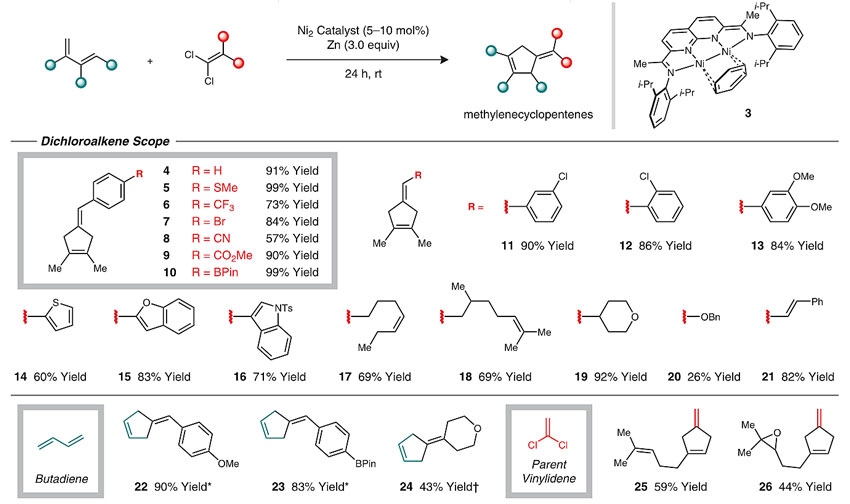
图4. 1,1-二氯烯烃底物的扩展。图片来源:Science
对于不对称的1位取代、2位取代、1,2-双取代和1,3-双取代的丁二烯,反应理论上会产生环外双键的Z/E异构现象。结果显示,反应得到的烯烃立体选择性都比较高,尤其是1,3-双取代的丁二烯普遍能达到9:1至>20:1的高立体选择性(35-40)。
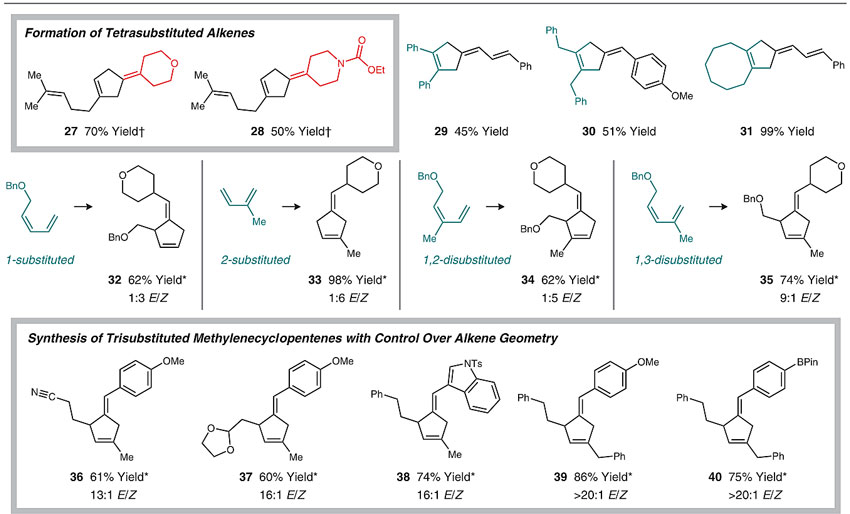
图5. 环外双键的立体选择性。图片来源:Science
得到的烯基环戊烯产物也能实现多种转化,比如经过n-BuLi去质子化后对FeBr2配位可得到六取代的二茂铁络合物(42),对开发新型的铁催化剂具有潜在的应用;经硼氢化-氧化或者氢化后能转化为多取代的环戊烷(43和47);苯基二氯乙烯底物和2-硅氧基二烯反应可生成环戊烯酮(45)。更有意思的是,这种方法还能应用在分子内反应构筑稠环体系(49-53),若在手性配体L10的参与下还能实现高对映选择性的环化,有望实现相关天然产物或药物结构的高效构建。
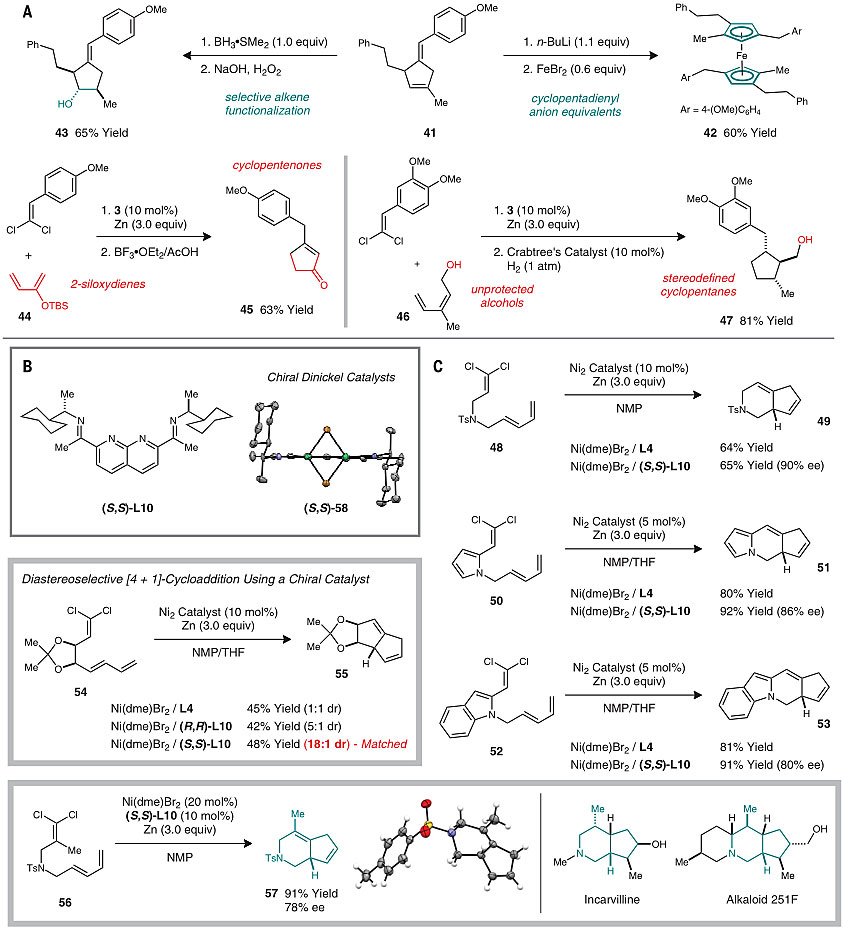
图6. [4+1]环加成反应的应用。图片来源:Science
回到机理探讨上来,这种转化会不会是之前猜测的先生成烯基环丙烷、再发生重排产生的呢?
为了验证这一猜想,研究人员合成了两种烯基环丙烷化合物60和61,然而在同样的催化体系下并没有生成预想的环戊烯41。另外,他们也验证了Zn单质对实现催化循环非常重要,因为在没有单质Zn的存在下,反应必须用过量的催化剂才能实现转化。结合之前研究[2+1]的机理和上述对照实验,研究人员提出以下机理:首先催化剂[NDI]Ni2Cl与1,1-二氯乙烯氧化加成,随后在Zn存在下进行第一次单电子还原,产生氯代烯基镍物种64,64第二次被Zn单电子还原后再发生C-Cl键氧化加成生成Ni2(vinylidene)(Cl) 65;之后65与1,3-丁二烯以η4 的方式进行配位,经迁移插入生成金属杂环中间体67,还原消除后得到烯基环戊烯产物。这种反应途径同样得到理论计算的支持。

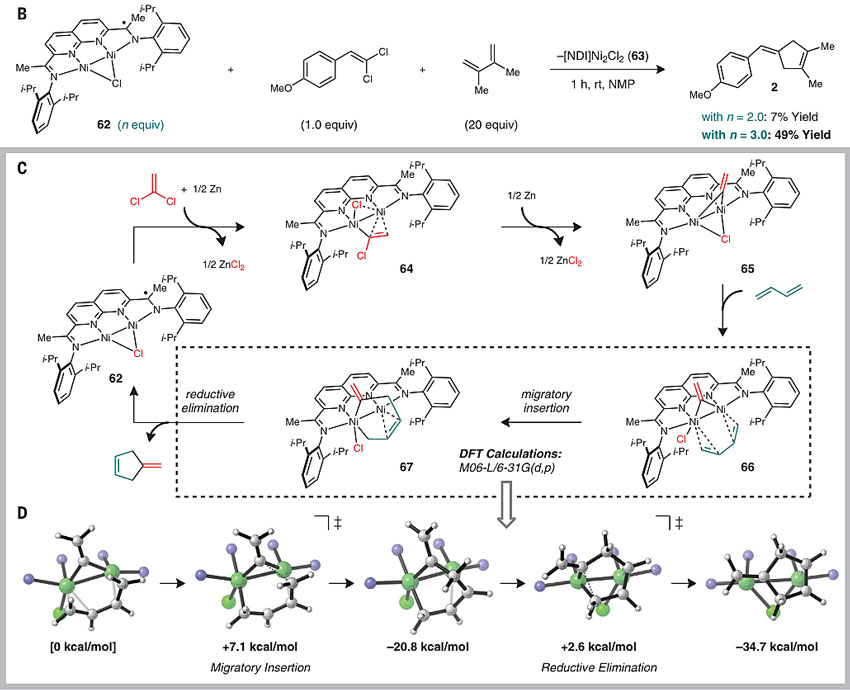
图7. 机理研究。图片来源:Science
总结
Christopher Uyeda教授团队突破[4+1]环加成反应电子禁阻的限制,以双核镍催化剂实现了亚乙烯基卡宾和1,3-丁二烯的[4+1]环加成反应,由此实现了烯基环戊烯结构的高效构建。其关键在于双核镍催化剂中的两个镍原子中心在C-C键形成的过程中可以协同稳定亚乙烯基卡宾与1,3-二烯形成的π体系。该反应还可借助手性配体实现对映选择性的环化,在天然产物及药物分子重要五元环结构的构建中具有潜在的应用。
PS,最后暴露年龄地无关感慨一下,看到“双核”,笔者第一时间想到的却是“哈维+伊涅斯塔”,有同感的请举个爪……
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalytic reductive [4 + 1]-cycloadditions of vinylidenes and dienes
Science, 2019, 363, 857-862, DOI: 10.1126/science.aau0364
导师介绍
Christopher Uyeda
https://www.x-mol.com/university/faculty/159
(本文由峰千朵供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号