Baran团队电化学合成的Science创新,灵感来自锂电池
碱金属与液氨混合具有很强的还原性,广泛应用于炔烃还原和Birch还原等反应。然而,在工业化规模生产中,使用碱金属作为强还原剂存在诸多不便。Birch还原在当代最具代表性的应用是辉瑞公司发展的抗帕金森病候选药物sumanirole(2)的50公斤级合成(图1A)。合成前体1的氮丙啶开环/脱苄基串联反应需要使用特殊定制的设备,以及气态下足以充满三架波音747客机的氨方可进行,低温条件(-35 ℃)下反应结束释放出2300升氢气(H2)。看过电影《流浪地球》的人都知道,氢气是多么易燃易爆,这么大量的释放,听起来就让人生畏。在碱金属还原的众多替代方法中,电化学还原无疑是最理想的方案。1946年,Birch本人首次报道了电化学介导的甲苯还原反应(NaOEt/NH3)。随后,许多课题组在该领域跟进并做出了开拓性的工作(图1B、1C)。但电化学还原通常存在大量的副反应,包括质子还原、溶剂电解导致电极钝化以及O2引起的产率降低等。因此,目前的电化学还原过程仍然难以实现优异的化学选择性和规模化应用。
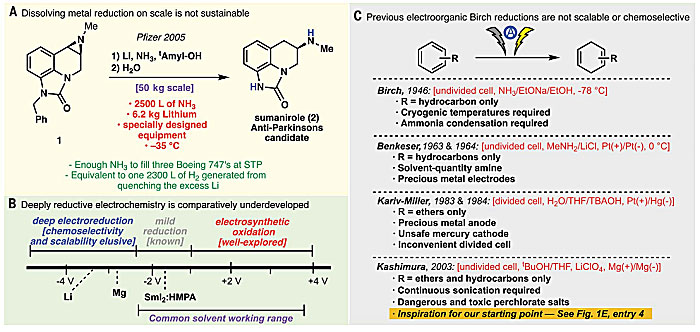
图1. 研究背景。图片来源:Science
寻求可循环使用、安全和高能量密度的锂离子电池同样也是人们关注的问题,人们通过不懈的探索,发现合适的添加剂、溶剂以及电解质是促成以上目标的关键。固体电解质界面(SEI)能够通过过充电保护防止电极过度钝化,并在极端的电位下提供更加有效和稳定的电极界面(图2A)。受锂离子电池技术的启发,美国斯克里普斯研究所(The Scripps Research Institute,TSRI)的Phil Baran教授(点击查看介绍)课题组设想借鉴锂离子电池体系设计的方式对电化学还原过程进行优化。近日,他们与犹他大学的Shelley D. Minteer(点击查看介绍)、明尼苏达大学的Matthew Neurock(点击查看介绍)等研究者合作,发展了安全和可扩大规模的电化学Birch还原,反应使用镁(Mg)或铝(Al)作为牺牲电极材料,廉价无毒的1,3-二甲基脲(DMU)作为水溶性的质子源,三吡咯烷基磷酰胺(TPPA)作为过充电保护剂,无需除去空气或水分,在室温下即可进行。该方法相对于传统电化学及碱金属作为还原剂的反应具有更广泛的官能团兼容性,并且可以应用于消除苄基、环氧化物/氮丙啶开环和McMurry偶联等常规反应。相关研究成果发表在Science 上。
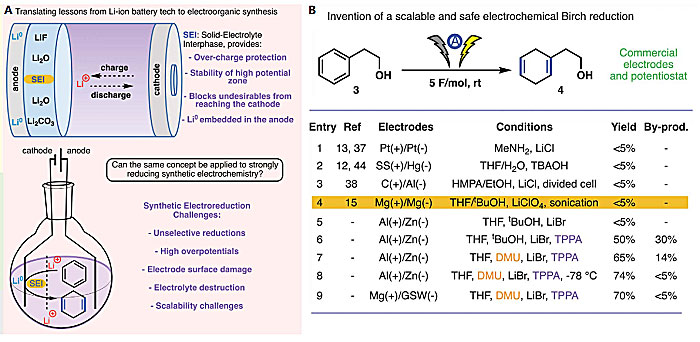
图2. 借鉴锂离子电池体系的安全和可扩大规模的电化学Birch还原。图片来源:Science
首先,作者选择苯乙醇(3)作为模型底物,参考以往文献中报道的反应条件对该反应的条件进行探索(图2B)。他们以Kashimura等人报道的方法为基础进行条件优化,3在原始条件下反应活性很低。LiBr具有更高的稳定性,但使用LiBr替代LiClO4仍然仅检测到痕量产物(entry 5)。作者发现反应过程中阴极明显积聚了金属样物质,并且其能够与水、甲醇反应,作者推断这种物质是金属锂(Li)。而锂离子电池研究早期便出现过由于过度充电引起Li积聚的问题。为了解决这个问题,作者借鉴以往的工作考察了几种抑制锂离子电池中过度充电效应的添加剂,TPPA可显著提高产物的产率(50%),但产物异构化和过度还原的副产物较为显著。将质子源换作DMU并降低温度,产率和选择性得到进一步提高。阳极由Al换作Mg并增加阴极的电流密度,反应在室温下具有理想的产率和选择性(entry 9)。
接着,作者研究了该反应的机理(图3)。在-78 ℃的惰性气氛下,体系不加入底物和DMU进行正常电解。电解完成后加入底物并进行搅拌,体系每隔30分钟取样检测。随着时间的推移,底物浓度略有下降,但在此期间并未检测到所需产物或明确的副产物。作者认为Li0不是反应中的活性还原剂,芳香烃底物可能在电极表面直接发生还原。随后,作者通过理论计算和电分析实验进一步支持了以上机制。作者在反应动力学研究中未观察到诱导期,并且不存在副反应竞争过程,3到4的转化符合零级动力学。
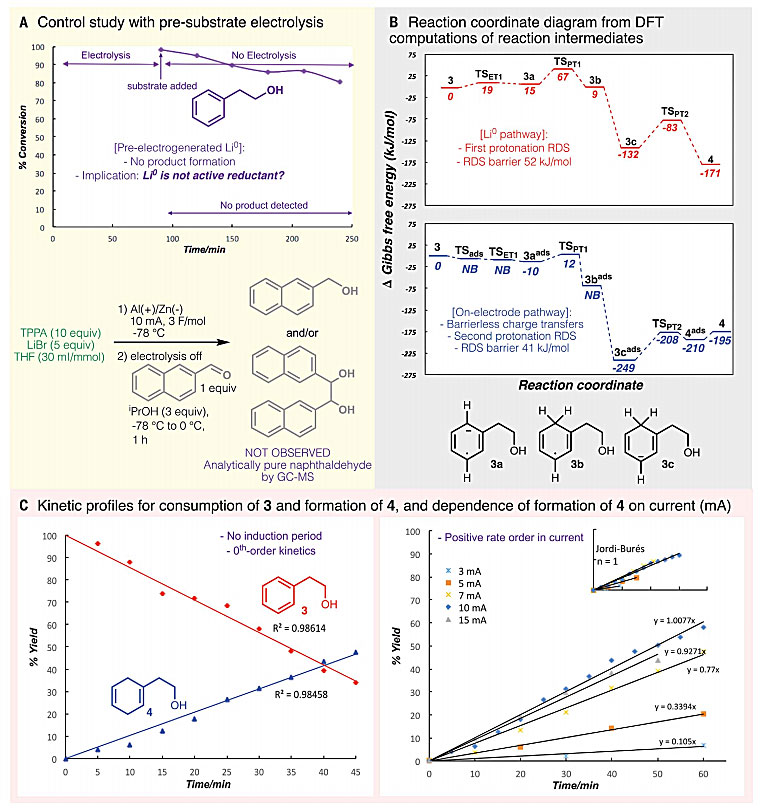
图3. 苯乙醇电化学还原的实验和理论分析。图片来源:Science
另外,作者通过伏安法研究了萘(5)的微观电化学过程(图4)。反应经历了两次电子转移和两次质子化过程,由此可分为“电子转移、电子转移、质子化、质子化(EECC)”和“电子转移、质子化、电子转移、质子化(ECEC)”两种机制。循环伏安法(CV)分析结果表明,改变CV电位窗口对扫描的可逆性有影响,不符合连续的电子转移(EE)机制,两次电子转移被质子化过程分开,反应经历ECEC机制。该实验还突显了Li+对促进反应进行的关键作用。衰减全反射红外光谱(ATR)实验证明Li+与DMU之间存在络合作用。基于这些研究结果,作者提出了如下反应机理(图3D):底物在电极作用下发生单电子还原、质子化,进而发生第二次单电子还原和质子化。Li+与DMU形成强配位的络合物,由此拉近DMU和5的自由基阴离子。作者还向5/DMU/LiBr的混合溶液中加入TPPA,并未导致电子转移速率增加,表明TPPA可能未参与反应的循环过程,而是对电化学过程产生辅助作用(图4C)。作者使用X射线光电子能谱(XPS)研究了电极表面的形态以及阳极衍生的镁盐在反应机理中的可能作用。体系在不加入TPPA时,电极表面会形成较厚的钝化层,条件优化后,反应开始时电极表面仍旧会形成较薄的钝化层,但几分钟内停止增长并保持稳定。这种钝化层可参与形成稳定的SEI,并为反应提供活性电极表面。而产生的镁盐对该反应没有明显的影响。
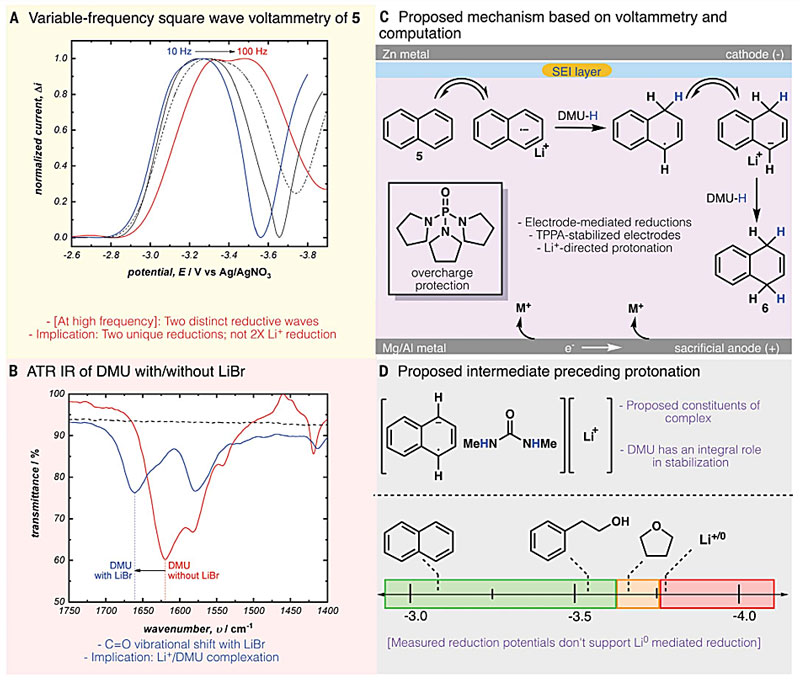
图4. 电化学分析确定不同反应组分的作用。图片来源:Science
作者考察了该电化学还原反应的底物适用范围(图5)。在优化的条件下,各种取代基修饰的芳香烃均可以顺利参与反应。氨基甲酸叔丁酯(16)、酰胺(17)、羧酸(18、19、21和22)和硅烷(23)都可以与体系兼容。不适用于常规Birch还原的杂环芳香烃也可作为合适的底物反应。一些复杂的天然产物右美沙芬(32)、脱氢松香酸(33)和雌酮甲醚(34)在电化学Birch还原条件下也可高效还原,进一步证明了反应条件的温和。
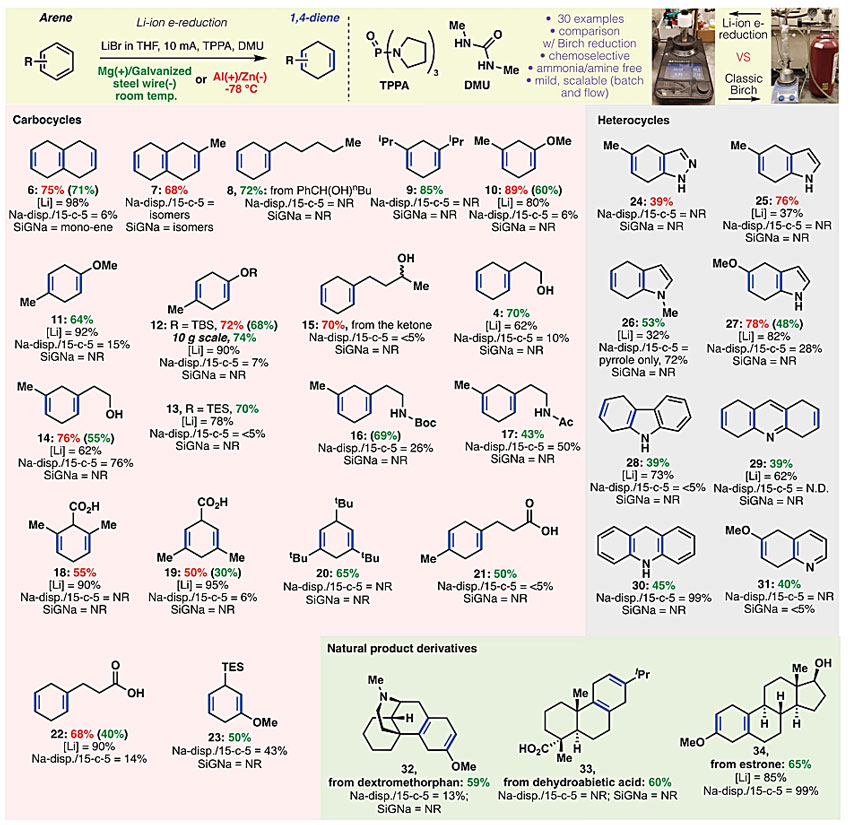
图5. 电化学Birch还原的底物适用范围。图片来源:Science
最后,作者进一步研究了该反应条件对除Birch还原反应外其他反应的效果(图6A)。苄基醚消除苄基、芴酮还原脱氧、环氧化物开环、呋喃环开环等反应均可以高效地实现。值得注意的是,McMurry偶联也可以在室温下完成。相比之下,常用于替代Birch还原的反应体系(SiGNa-S1和Na-dispersion/15-crown-5)却无法实现以上过程。另外,该方法可成功应用于药物前体12的批次和流动合成。他们构建的模块化流动合成设备非常简单(图6B),可以安全、可持续地将合成规模增加几个数量级,即使在100克规模下也可以实现完全相同的转化效果,无需对方法进行重大的改变,也不会影响收率。
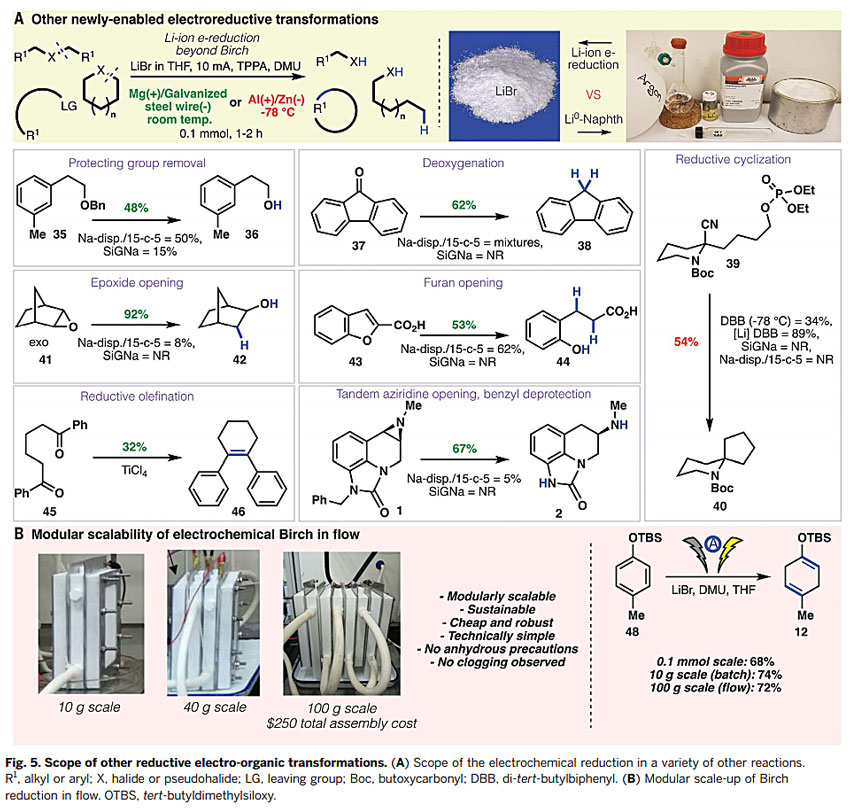
图6. 其他电化学还原的转化过程。图片来源:Science
结语
近一个世纪以来,电化学还原已成为合成领域的研究热点。尽管这一概念极具吸引力,但由于受到实际应用和化学选择性等因素的制约,其大规模的推广受到限制。受锂离子电池技术发展的启发,Phil Baran课题组与Shelley D. Minteer课题组、Matthew Neurock课题组合作开发的这一套通用的电化学还原条件表现出非凡的实用性、安全性、可规模化性和化学选择性。在C&EN 的报道中 [1],中国农业大学的安杰教授评价到,如果可以将TPPA($133/5 mL, MilliporeSigma)替换为更加廉价的添加剂,这种方法将会迎来更为广泛的应用。Baran也表示,在进行某些底物大规模的流动反应时,TPPA完全可以省略,他们也相信,未来电池技术和电活性材料的快速发展将会为合成方法学的设计带来更多的灵感,并为有机合成电化学带来深远的影响。
化学家都希望让化学反应变得更绿色、更安全、更廉价、更高效,这一定程度上代表着实验室成果应用于实际生产的可能性,毫无疑问,Baran、Minteer、Neurock等人的这项工作是一个很好的示范。另外,科学是相通的,多看看其他领域的研究,很有可能会带来求之不得的灵感,帮助解决本领域内的棘手问题。(潜台词:平时没事多看看X-MOL的各领域报道吧……)
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Scalable and safe synthetic organic electroreduction inspired by Li-ion battery chemistry
Science, 2019, 363, 838, DOI: 10.1126/science.aav5606
导师介绍
Phil Baran
https://www.x-mol.com/university/faculty/668
Shelley D. Minteer
https://www.x-mol.com/university/faculty/1748
Matthew Neurock
https://www.x-mol.com/university/faculty/58861
参考资料:
1.http://cen.acs.org/synthesis/process-chemistry/Safe-scalable-electroreduction/97/i8
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号