不对称催化α-醇酮的重排反应
α-醇酮重排反应(α-ketol rearrangement)是指从α-羟基羰基化合物转变为其结构异构体的反应,往往包含烷基迁移或芳基迁移。该类反应通常在酸性、碱性或者加热条件下生成热力学更稳定的异构体。该类反应广泛应用于天然产物全合成及其结构修饰。手性α-羟基羰基化合物是药物、农药以及其他生物活性分子合成中的重要骨架和前提,而非手性的α-羟基酮经过重排后产生的结构异构体通常具有一个手性中心,因此发展不对称催化的α-醇酮重排反应具有十分重要的合成意义。然而,由于反应本身的可逆性,不对称催化α-醇酮的重排一直是困扰化学家们的科学难题。尽管Brunner和Kagan课题组对该类反应的不对称转化进行了一系列深入的研究和不懈努力,然而反应的对映选择性最高却只有48%,而且底物也非常受限。

最近,瑞士洛桑联邦理工学院(EPFL)的祝介平(点击查看介绍)团队(LSPN)采用产物ee值原位放大策略,首次实现了高对映选择性的α-醇酮重排反应,高效合成了一系列手性1,3-二羰基叔醇化合物及其衍生物,反应规模能扩大到克量级。这一研究成果近期发表在Angew. Chem. Int. Ed. 上,文章的第一作者为吴华博士。
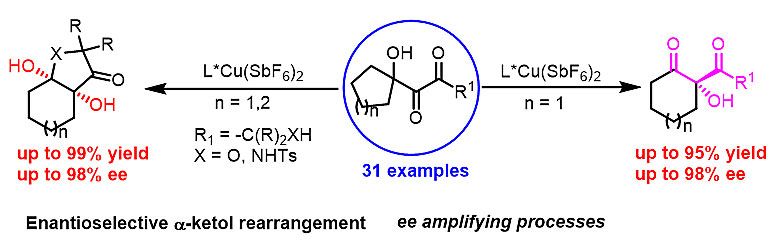
研究初始阶段,作者对一系列不同类型的催化剂进行筛选,最终发现使用Cu(SbF6)2结合手性双噁唑啉配体能够获得最好的立体选择性结果,同时反应底物能够很好地与该手性路易斯酸发生二羰基配位作用。值得注意的是,该重排反应区别于传统的不对称转化,而是经历先后两步立体选择性控制过程。一方面,手性铜首先催化第一步的不对称重排反应,之后生成的目标产物继续在手性铜的催化作用下发生原位动力学拆分过程,继而导致产物ee值进一步提高,生成一系列手性1,3-二羰基叔醇化合物。另一方面,作者采用手性铜催化的不对称重排反应,结合第二步的动力学半缩醛化或半缩胺化环化策略,高收率、高对映选择性地合成了一系列手性1,2-二醇化合物。同时,作者也设计了一系列控制实验对反应机理进行验证。
该不对称α-醇酮重排反应具有良好的底物适用性,原料简单易得、反应条件温和,以上两种类型产物采用其他方法均难以获得。此外,该不对称重排反应也成功应用于内消旋化合物的去对称化转化以及消旋底物的动力学拆分。
该论文作者为:Hua Wu, Rémi Andres, Qian Wang, Jieping Zhu
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalytic Enantioselective α-Ketol Rearrangement
Angew. Chem. Int. Ed., 2019, 58, 499, DOI: 10.1002/anie.201812244
导师介绍
祝介平
https://www.x-mol.com/university/faculty/2766
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号