Science:合成未保护伯胺的“盐铁之利”
脂肪族伯胺结构广泛存在于生物活性分子中,并可作为进一步构建仲胺、叔胺和杂环结构的重要前体。传统合成伯胺的方法主要依赖于还原胺化、醇的脱氢偶联、烯丙基胺化、叠氮化物或腈的还原等,而这些方法都需要在底物中预先修饰极性基团。另一种策略是使用烯烃作为原料,以烯烃的氢胺化、氨基羟基化以及叠氮化等方法来构建,但这类反应一般需要预先对氮原子进行保护基修饰,随后再消除保护基,或是需要以芳基取代基活化烯烃(图1A)。Falck和Kürti等人报道了铑催化烯烃氮丙啶化的方法完成了烯烃的氨官能化,但随后进行区域选择性开环时却遇到难题。从非活化的烯烃出发,直接以催化的途径区域选择性转化为未保护的胺类化合物仍是有机化学中急需解决的问题。

图1. 合成未保护胺的策略。图片来源:Science
近期,德国马克斯•普朗克煤炭研究所的Bill Morandi教授课题组做出了突破。他们以稳定的羟胺盐为氨源,氯化钠作为氯源,在简单铁催化剂存在下实现烯烃的氨基氯化反应以合成未保护的伯胺。该反应可以在室温及空气氛围下进行,对一系列脂肪族、共轭烯烃甚至高度官能化的底物均具有很好的适用性,并以优异的反马氏规则选择性得到线性的2-氯烷基胺产物。相关工作发表在Science 上。
以催化的手段在分子中引入未保护的氨基(尤其是一级碳位点),同时在二级碳位点引入多种不同的亲电基团具有重要的意义。未保护的2-氯烷基胺原则上可以发挥两性氨基合成砌块的作用,这类分子很少在文献中报道,通常需要氨基醇直接氯化或氮丙啶开环得到,或者从烯烃出发得到Ts基团保护的衍生物,但在氯原子存在的情况下,选择性断裂N-Ts键存在一定的困难,底物适用范围与收率都不理想。Bach等人曾报道了铁催化分子内的氨基氯化反应,但产物是氯取代的噁唑烷酮,而不是未保护的2-氯烷基胺。
在亲电胺化反应中使用氯作为亲核试剂不仅可以获得目标产物2-氯烷基胺,而且还能解决传统非活性烯烃反应活性差的问题。以往发展的铁催化的氨基羟基化反应和醚化反应底物适用范围均有限(图1B),该类反应需要借助碳自由基的单电子氧化过程形成碳阳离子,对于形成非苄基自由基的底物存在很大的挑战。氯代烷烃易发生均裂取代反应,如果氮中心自由基进攻C=C双键产生不稳定的自由基中间体,该中间体可以与氨基配位的铁(III)络合物迅速发生氯原子转移,形成所需的产物并再生铁(II)催化剂。该过程不涉及额外的单电子转移步骤或阳离子中间体的形成,因而可能具有更广泛的底物适用范围。
作者在空气条件下进行初步的概念验证实验,考察了各种羟胺类试剂,将化学计量的FeCl2加入1-十二碳烯的溶液中(图1C)。尽管反应的产率低,但能明显观察到产物生成。随后作者考察了不同的氯化物来源,发现温和且易于处理的氯化钠具有更好的效果。反应的最佳条件是使用廉价的乙酰丙酮铁(II)作为催化剂,氯化钠作为氯源,羟胺衍生的盐1作为氨源,室温下在甲醇/二氯甲烷的混合溶剂中进行,能以72%的产率分离得到2-氯烷基胺,且没有检测到区域异构体产生。
作者接下来探究了该反应烯烃的适用范围,对于不同的末端烯烃,其中一些底物含有在过渡金属催化中不利的未保护的极性基团(如氰基6和羟基3、15和16等),都能以良好的收率得到相应的产物(图2),碱性的三级氮中心(35、18、38和39)也可与该反应兼容。药物研发中常见的杂环结构如四唑(19)、氧杂环丁烷(20)、嘌呤(38)和炔(15)也不会对反应造成明显的影响。芳香族卤素原子(12和13)可通过交叉偶联反应进一步官能化,相应的底物在该体系中也能以良好的收率得到所需的产物。即使在起始原料中存在两种烯烃(16、17和34)的情况下,反应也只生成单官能化的产物。除单取代的烯烃外,1,1-(36和37)和1,2-(23至25)二取代的烯烃以及三取代的烯烃(26)也都能以高产率得到相应的产物。苯乙烯(27至33)也可用作为合适的底物,然而苄基氯化物不稳定,产物分离存在一定的困难。

图2. 活化及非活化烯烃参与反应的底物适用范围。图片来源:Science
作者还进一步探讨了复杂官能化烯烃底物的适用范围。异山梨醇(34)的衍生物以及几种结构上复杂的萜烯衍生物(36、37、40和41)都能以良好的收率进行氨基氯化。含氮生物活性分子,例如2-(羟甲基)-5-乙烯基奎宁环(35)、脯氨醇(39)甚至是未保护的腺嘌呤(38)参与反应都能得到相应的胺化产物,而这些底物在参与其他过渡金属催化的胺化反应时均存在挑战。
作者还进一步尝试了对产物进行衍生化,2-氯烷基胺可以很容易地还原成相应的胺(42),改变还原剂和溶剂甚至能够获得马氏选择性的氢胺化产物(43),常见的亲核试剂(例如叠氮化物(46)和氰化物(47))对原位产生的氮丙啶开环会分别生成合成二胺和氨基酸的通用前体。2-氯烷基胺在碱存在的条件下也可轻松获得相应的氮丙啶(45),与烯丙基溴化镁反应可在氨基的α位形成C-C键,得到未保护的高烯丙基胺(44)。
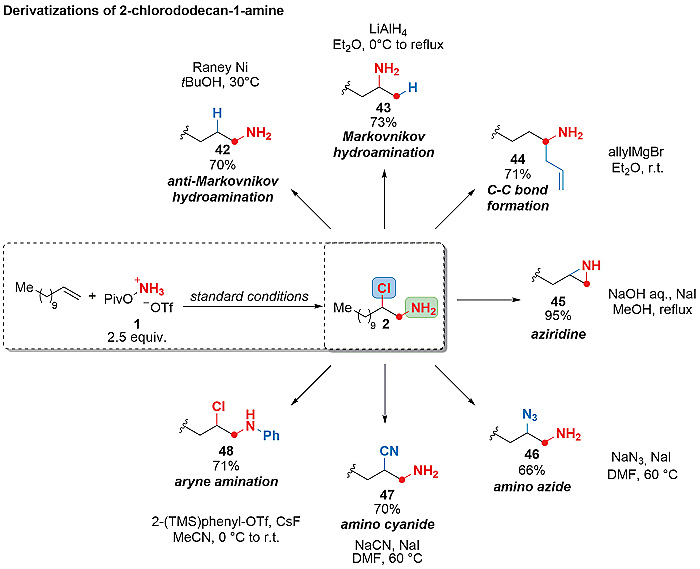
图3. 2-氯-1-十二胺的衍生化。图片来源:Science
作者还进行了初步的机理研究,使用顺式和反式的环十二烯参与反应分别得到相应产物(49和25),收率良好,立体化学得到很好地保持(图4A)。而使用顺式和反式的β-甲基苯乙烯参与反应则得到完全不同的结果(图4B),立体选择性无法很好地保持,并且两种起始材料转化成氮丙啶后产生的主要产物是相同的立体异构体。两类底物之间的不同结果与所提出的机理模型一致(图1B)。反应以非稳定的脂肪族烯烃作为底物,其中氨基配位的铁络合物可快速转移来自同一面的氯原子,立体化学得以保持;而对于苯乙烯类底物,自由基中间体快速氧化形成稳定的苄基阳离子,由此影响反应的立体化学。

图4. 反应机理的研究。图片来源:Science
接下来作者通过实验证实脂肪族烯烃在反应过程中形成自由基的假设。反应速率较快的自由基钟实验支持自由基中间体的形成,环丙基发生开环(图4C)。结合脂肪族烯烃反应时立体选择性高度保持(图4A)和另一个自由基钟实验未成功进行,作者提出反应过程中形成短寿命的碳自由基中间体。使用TEMPO和BHT进行自由基捕获实验也进一步支持了这一结论,两者基本上不影响反应效率。Hammett实验表明,富电子底物参与反应的速率较快,由此说明反应涉及亲电性的胺对烯烃进攻的机制(图4D)。作者最后还试图通过快速阳离子重排过程捕获可能的碳阳离子中间体(图4E),但并没有观察到重排,也进一步支持了自由基机理。
总结
Bill Morandi课题组报道了铁催化多种烯烃的氨基氯化反应,以优异的区域选择性得到未保护的2-氯烷基胺产物。该反应通过氨基配位的铁(III)络合物发生分子内的顺式氯原子转移,实现了分子内不稳定的碳自由基的直接、快速捕获,立体化学得到很好地保持。该方法可在室温及空气氛围下进行,反应简单成本低,对含氮化合物的高效合成具有重要的应用价值。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Efficient access to unprotected primary amines by iron-catalyzed aminochlorination of alkenes
Science, 2018, 362, 434, DOI: 10.1126/science.aat3863
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号