这一小撮黄色粉末,可能是简化自由基化学的关键
自由基是具有不成对电子的原子或基团,性质活泼,利用自由基作为中间体能解决离子化学等经典手段难以解决的问题,在有机合成、材料科学和生命科学等领域具有广泛的应用。传统的方法常使用重氮化合物、过氧化物等引发剂诱导生成自由基,或者利用氧化剂、还原剂及电化学手段通过氧化还原过程形成自由基(图1a)。由引发剂诱导形成的自由基与底物的键离解能(bond dissociation energy, BDE)有很大关系,氧化还原过程生成自由基则是通过单电子转移(single-electron transfer, SET)途径实现的,两种方法均可形成开壳层的自由基中间体I。然而传统方法的反应条件通常比较苛刻,有时需借助有毒或易爆试剂、高温处理和紫外光照射等,由此限制了反应的选择性和官能团兼容性。为了实现在温和条件下产生自由基,科学家利用含硫化合物作为自由基前体及底物(图1b左),如Barton等人发展的黄原酸酯转移化学,大大拓展了形成自由基的底物适用范围,但此类方法依然需要制备化学计量的含硫试剂。近年来,人们发现光氧化还原催化剂能在较温和的条件下以催化循环的方式产生自由基(图1b右),该类反应一般是通过SET机理进行,也可以通过氢原子转移方式进行,但都需要预先考察底物的氧化还原性质或者BDE。因此,寻找新型的温和形成自由基的策略依然是一个挑战。

图1. 形成自由基的策略。图片来源:Nat. Chem.
近日,西班牙加泰罗尼亚化学研究所(ICIQ)的Paolo Melchiorre教授等人发展了一种新策略,通过在亲核的二硫代氨基甲酸盐阴离子催化剂修饰特定的发色团,以SN2途径活化烷基卤化物等一系列烷基亲电试剂,得到的光子吸收中间体在可见光诱导下发生均裂产生自由基(图1c)。该反应基于离子化学机理可促进一系列烷基亲电试剂形成自由基中间体,包括传统方法不能形成的自由基物种。相关工作发表在Nature Chemistry上。

图2. Paolo Melchiorre教授及其研究组成员。图片来源:ICIQ
作者首先提出了可能的反应机理,二硫代羰基阴离子1作为亲核性催化剂与烷基亲电试剂2反应,其中1经过SN2历程取代2中的离去基团得到中间体II(图3a)。中间体II的C-S键较弱(如苄基-N,N-二甲基二硫代氨基甲酸酯,BDE=31.3 kcal•mol-1)。在低能量光子条件下,该C-S键即可断裂生成目标自由基III和二硫代羰基自由基IV。自由基III能与缺电子烯烃反应形成C-C键,并形成亲电自由基V。而V可以从1,4-环己二烯(1,4-cyclohexadiene,1,4-CHD)攫取氢原子形成最终的产物4和环己二烯基自由基VI。接着二硫代羰基自由基IV与VI发生SET还原反应,同时重新生成催化剂1,由此完成催化循环。该机理通过以下几点得到证实:(1)二硫代碳酸根和二硫代氨基甲酸根阴离子具有很强的亲核性;(2)II型硫代羰基化合物光解时能生成自由基并促进聚合反应发生;(3)1,4-CHD既能提供氢原子,还能提供电子。

图3. 光引发生成自由基的机理与相关反应。图片来源:Nat. Chem.
为了验证该方法,作者对Giese自由基共轭加成反应进行了研究(图3b)。为了证明该方法能在温和条件下活化其他方法不能活化的底物,反应以苄基氯2a和富马酸二甲酯3a作为模板底物,乙腈作为溶剂,同时以价格便宜、性质稳定的γ-萜品烯代替1,4-CHD作为氢原子和电子供体。2a作为苄基自由基的前体,其还原电位(Ered (2a/2a–)= -2.13 V vs SCE)远比大多数常用的光氧化还原催化剂更负,通过2a的SET还原反应形成苄基自由基需要化学计量的还原剂,而它是SN2反应的典型底物。当反应用波长400 nm的光照射时,乙基黄原酸钾1a作为亲核试剂,目标产物4a的产率是19%(图3b,entry 1),由此证明光引发可以产生苄基自由基。将蓝色LED灯光波长调至465 nm时反应不再进行(图3b,entry 2),可能是因为SN2反应得到的黄原酸酯中间体IIa不能吸收蓝光(图3c)。因此,作者对亲核催化剂1修饰发色团,1b和1c分别为修饰咔唑和吲哚结构的硫代氨基甲酸酯催化剂,SN2反应之后得到中间体IIb、IIc。与IIa相比,IIb、IIc的摩尔吸光系数极大增加,因而在蓝光照射下具有催化活性(图3b,entry 3和4,λmax= 465 nm)。作者以1c为催化剂,将反应温度升至60 ℃时3的产率达到90%(图3,entry 5)。而在对照试验中,无催化剂或者光照时体系没有产物形成。当体系存在自由基抑制剂2,2,6,6-四甲基哌啶氧化物(TEMPO)时,反应活性得到抑制,体系未经严格除氧时产率会稍微下降(图3,entry 6)。另外,作者以水作为共溶剂并且未除氧时,该反应的产率也很高(图3,entry 7)。
随后,作者探究了该方法的底物适用范围,由反应机理可知,能发生SN2取代反应的苄基化合物即可进行该反应。分别修饰碘、溴、甲磺酸酯和三氟乙酸酯官能团的苄基化合物2b-e都可以高产率制备4a。即使是苄胺的衍生物Katritzky盐2f也可实现以上过程,而离去基团(如醋酸基、磷酸基)难以发生SN2反应时则无法得到相应的产物。作者还探究了亲核催化剂1c催化Giese加成反应制备富马酸3a(图4a)的底物适用情况,发现含有给电子及吸电子芳基取代基的苄基亲电试剂都可作为反应底物(2g-j)。二级苄基化合物2k和氯代异戊烯2l(一种烯丙基自由基的前体)也可以中等产率制备相应的共轭加成产物。另外,该反应不仅能实现自由基的α-氨基甲基化,用于引入噁唑烷酮结构(2m-o),对于含氮杂环类底物也具有很好的兼容性(2p-s)。当底物存在未保护的极性官能团(如芳基碘(2t)、游离的羧基(2u)、醇(2v)和醛(2w))时,反应都能顺利进行。含有吸电子基团(如酯、氰基、砜和酰亚胺)的烯烃也可以通过该策略制备相应的产物5a-e。
作者认为富电子的芳基化合物与自由基作用可以生成环己二烯自由基VI,避免了化学计量氢原子供体的使用,这一过程可用于制备(杂)芳香族化合物。芳基丙烯酰胺6经过连续的自由基加成/环化反应(1c作为催化剂)得到一系列取代的羟基吲哚衍生物7(图4c)。同样,富电子的(杂)芳香族化合物(包括未保护的吡咯8i)也可直接以氯代烷烃作为自由基前体实现自由基官能化(图4d)。醛基、仲胺和游离羟基等官能团均可与该反应体系兼容。再一次证明该催化体系具有良好的应用范围。
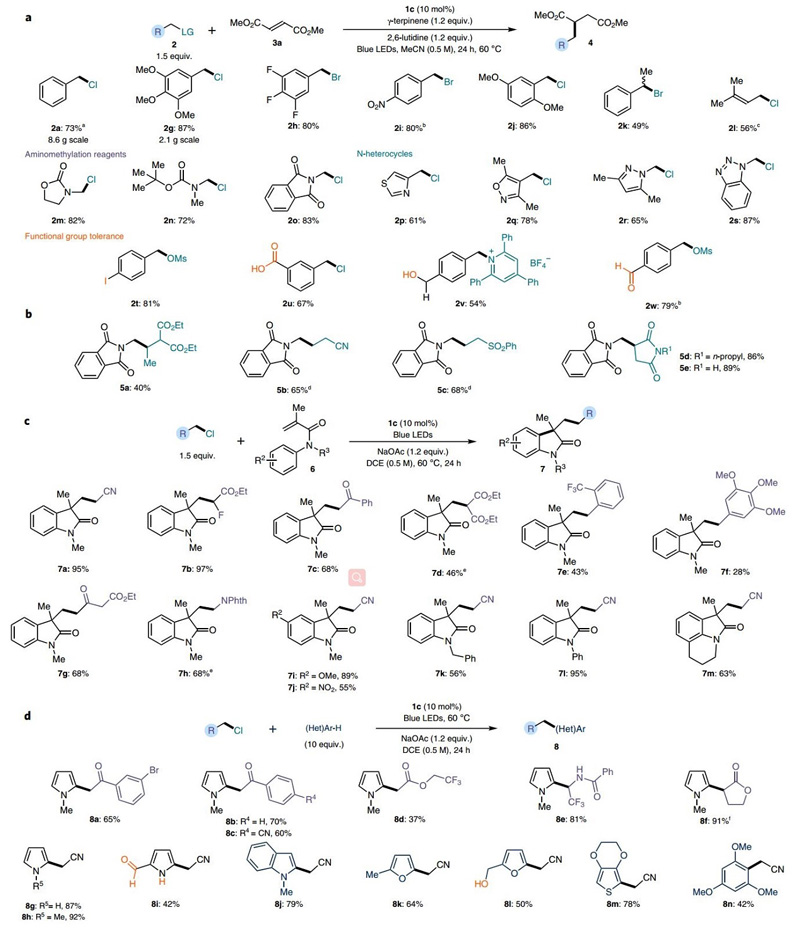
图4. 蓝光引发形成自由基反应的底物适用范围。图片来源:Nat. Chem.
最后,作者基于该方法合成吡咯衍生物8h以证明其实用性(图5a),8h是合成非甾体类抗炎药的一种中间体。作者只使用5 mol%的催化剂1c就可在乙酸乙酯中以克量级规模合成8h。吡咯衍生物10和羟基吲哚化合物也能够通过后期修饰直接与甲磺酸酯9反应,碱基类似物13和16分别可由6-(氯甲基)尿嘧啶12和腺嘌呤14制备。这些结果进一步证明该方法适用于含极性官能团的生物活性分子的官能化。此外,以往的方法利用溴代丙二酸二乙酯18a和手性仲胺催化剂19a选择性地制备产物20(图6a),都使用溴代烷烃作为自由基的前体。该工作以烷基氯化物作为自由基的前体,二硫代羰基阴离子1c对其有效活化实现对醛类化合物17的选择性烷基化。
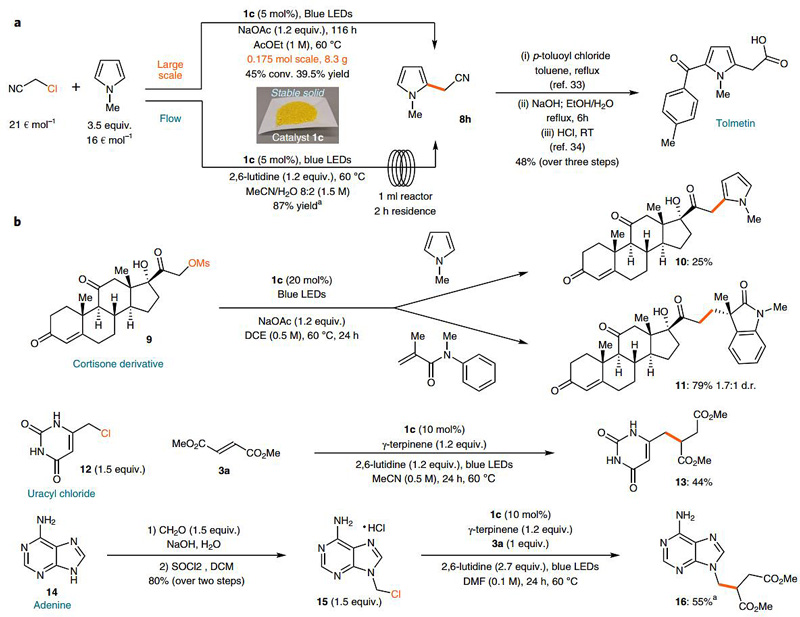
图5. 蓝光引发形成自由基反应的合成应用。图片来源:Nat. Chem.

图6. 蓝光引发形成自由基策略用于选择性自由基催化反应。图片来源:Nat. Chem.
总结
光化学过程极大地丰富了现代合成体系,为构建复杂的有机结构提供了强有力的方法。Paolo Melchiorre团队利用光化学催化策略促使一系列烷基亲电试剂通过SN2历程产生自由基中间体。反应操作简单、稳定性强,具有良好的底物适用范围与官能团兼容性,涉及的试剂廉价易得,并且催化剂稳定性好,不受空气及其湿度影响。该方法有望在药物合成及研发中得到广泛的应用。

图7. 实验室环境下稳定的催化剂。图片来源:ICIQ
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Photochemical generation of radicals from alkyl electrophiles using a nucleophilic organic catalyst
Nat. Chem., 2018, DOI: 10.1038/s41557-018-0173-x
(本文由Sunshine供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号