一套催化体系“通吃”多种亲核试剂,Nat. Chem.报道酮类不对称α-官能化新策略
酮类化合物的α位对映选择性官能化反应在药物合成等领域具有重要的价值。该类反应一般是通过酮的烯醇化物与亲电试剂偶联得以实现。但是,烯醇化物与杂原子亲电试剂形成碳-杂(C-X)键时需要杂原子亲电试剂中的杂原子具有一定的亲电特性,并且这些试剂通常不具有最终产物中的取代基,由此使酮类化合物的α-官能化更加复杂,比如酮α位C-N键的形成可以亚硝基芳烃、偶氮二羧酸酯、叠氮基碘试剂和羟胺等试剂作为亲电试剂,但是初始形成的产物需要断裂氮-杂(N-X)键或消除氮原子修饰的酰基才能生成相应的胺。对于C-O键的形成也是如此,化学家已发展了亚硝基芳烃、氧杂吖丙啶、过氧化物甚至氧气作为亲电试剂的方法在酮的α位选择性引入氧原子,但实现羰基化合物与烷氧基盐及苯氧基盐的C-O键形成的方法仍旧很少。而形成C-S键需要使用二硫化物、次磺酰胺及次磺酰氯作为亲电试剂,使用硫醇盐无法实现。另外,反应中的烯醇化物通常具有手性,一系列催化剂(如手性胺、路易斯酸、相转移催化剂和光氧化还原催化剂)已经用于烯醇化物亲核试剂与碳亲电试剂的偶联,但是目前很难实现烯醇化物和杂原子亲电试剂的偶联。还有一些酮的α-官能化产物不能通过烯醇化物与烷基或者羰基亲电试剂反应得到,如1,4-二羰基化合物,该类产物一般是通过烯醇化物的氧化偶联制备,不过反应过程中无法控制手性(图1a)。因此,找到一种适用范围更广的方法在酮类化合物的α位对映选择性地形成C-C和C-X键成为值得思考的问题。
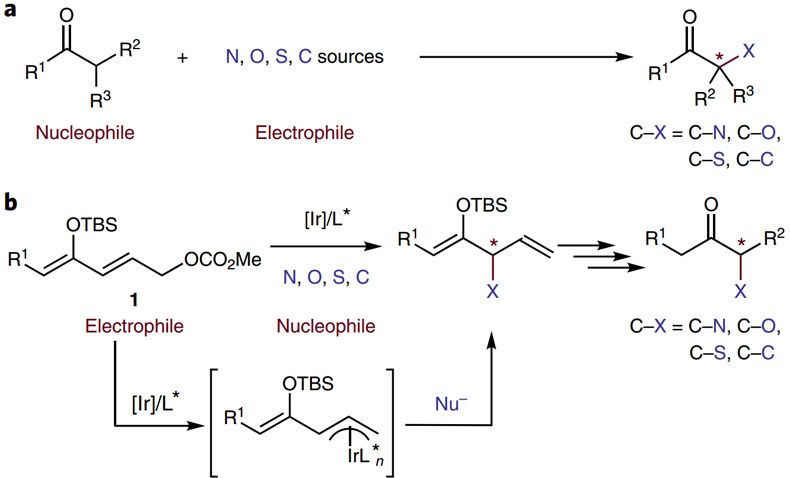
图1. 实现酮类化合物α-官能化的方法。图片来源:Nat. Chem.
最近,美国加州大学伯克利分校的John F. Hartwig教授(点击查看介绍)提出以叔丁基二甲基硅基作为保护基团修饰含有烯丙基酯的酮类衍生物,形成的烯醇硅醚作为亲电试剂,在铱催化剂的条件下形成烯丙基铱物种,进而与不同的杂原子及碳亲核试剂反应,以高产率及对映选择性实现了酮类化合物的α-官能化(图1b)。相关工作发表在Nature Chemistry 上,第一作者为Zhi-Tao He博士。

图2. John F. Hartwig教授和Zhi-Tao He博士。图片来源 :UC Berkeley
为了证明该方法中硅烷保护基团的重要性,作者首先使用未保护的γ-碳酸酯基烯酮(2a)作为底物(图3a),以苄胺为亲核试剂,体系只有2a与苄胺Michael加成的产物。为了避免Michael加成的竞争过程,作者将酮转化为相应的烯醇硅醚。当保护基团为三甲基硅烷(Trimethylsilyl,TMS)时(图3b),产物中依然有Michael加成反应的产物,而当保护基团为叔丁基二甲基硅烷(tert-butyldimethyl silyl,TBS)时(图3c),酮α位发生烯丙基取代的产率(7a)为58%,e.e.值为97%,枝状与线性产物的比例(branched to linear ratio,b:l)为13:1。这些结果证明选择合适的硅烷基团保护羰基对该反应具有重要的意义。
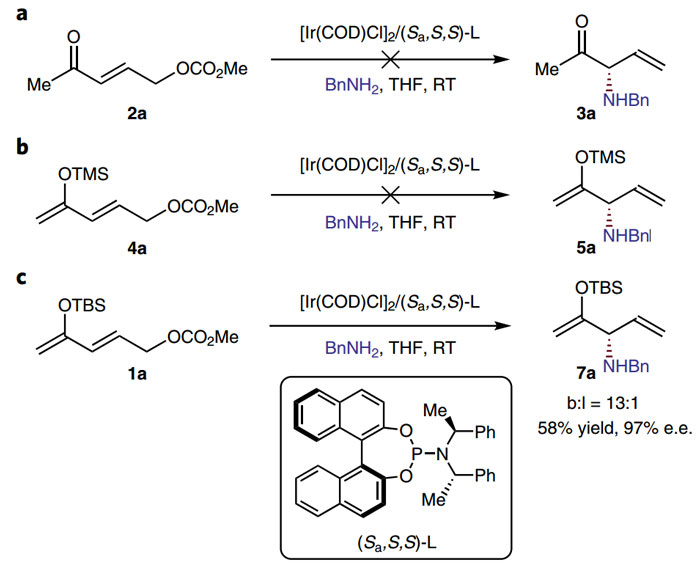
图3. 证明酮类化合物α-官能化中硅烷保护基团的重要性。图片来源:Nat. Chem.
随后作者研究了不同酮类化合物在TBS基团的保护下与不同种类亲核试剂反应的产率和对映选择性(图4)。由7a-7j的结果可得,无论底物中含有烷基、环烷基、苯基、烯基、氟、全氟烷基或者苯氧烷基,以苄胺为亲核试剂时产物的产率和对映选择性都较高。作为亲核试剂的胺适用范围也很广,从7k-7s可得,无论一级烷基胺是否具有手性,产物的产率和对映选择性都较高。手性胺具有其它官能团,比如含有羟基或四氢呋喃时可以高产率、高对映选择性和区域选择性地得到相应的产物(7q-7r)。另外,即使亲核试剂是手性的饱和烃基胺(7s)时产率也达到70%(d.r. = 95:5;b:l > 20:1)。当亲核试剂为二级烷基胺、芳香胺、杂芳香胺(7t-7y)或环状仲胺(7t、7x、7y)时,反应的产率、对映选择性和区域选择性都较高。只有芳香胺作为亲核试剂时,反应需要铱催化剂的预活化(常加入1,4-二氮杂二环[2.2.2]辛烷(1,4-diazabicyclo[2.2.2] octane;DABCO)),铱催化烯丙基取代反应需要碱辅助的环金属化形成金属杂环状催化剂,而芳香胺碱性弱,不能诱导该反应的发生。作者还研究了该方法在修饰氨基酸和氨基醇方面的应用,产物的产率和对映选择性同样也很好(8a-8e)。以上结果证明该方法对含氮亲核试剂具有良好的适用范围。
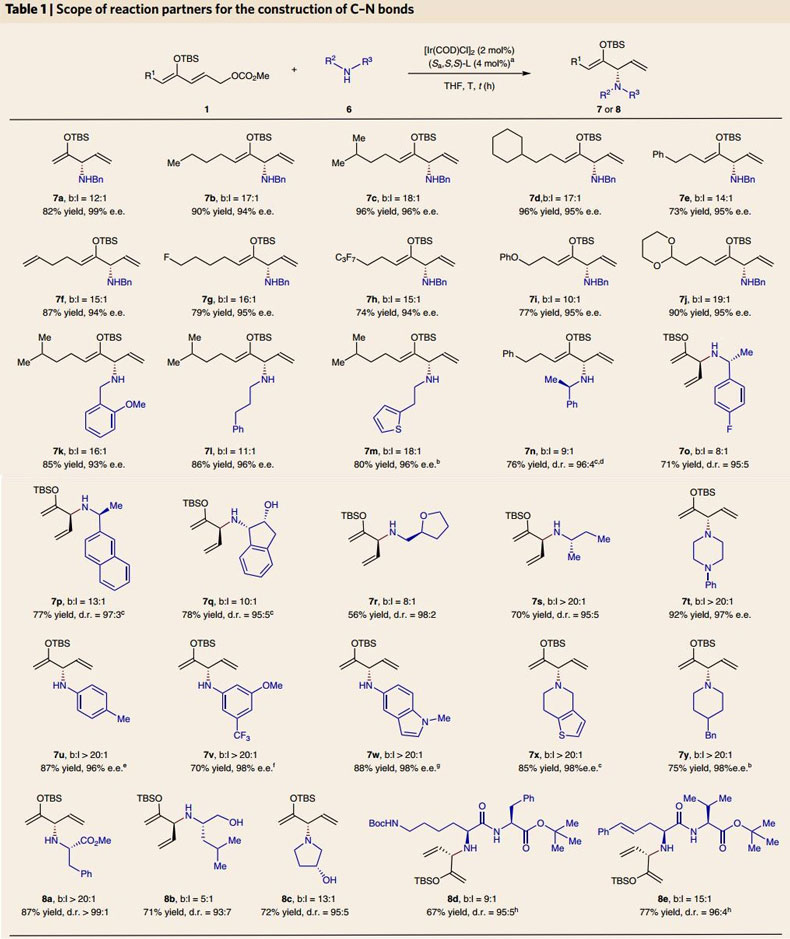
图4. TBS基团保护的酮衍生物与含氮亲核试剂反应的产率和对映选择性。图片来源:Nat. Chem.
另外,作者还研究了该方法在构建C-O、C-S和C-C键方面的适用情况(图5)。1a能与苯氧基盐反应得到9a(产率为71%;ee值为94%;区域选择性为13:1)。对于邻位有取代基的苯氧基盐,虽然反应温度较高、速率较慢,但是依然能高产率和高选择性地得到相应的产物(9b)。由氨基酪氨酸得到的氧亲核试剂衍生物也能参与该反应(9c-9f),即使是含有酪氨酸的多肽(9g)和相似结构的雌甾二醇(9h)也适用于该体系。传统制备α-硫化羰基化合物时硫具有亲电性,而在该工作中,反应以芳香硫酚钠作为亲核试剂,尽管硫原子常导致催化剂中毒,但在该体系中与1a反应,产物的产率、对映选择性和区域选择性依然很高(10a-10c)。4-甲基苯硫酚钠作为亲核试剂可以与不同的酮类烯醇化衍生物反应(10d-10i)。作者最后利用丙二酸酯和1,3-二酮化合物作为预亲核试剂,与酮类烯醇化物亲电试剂反应构建C-C键(图5,11a-11i)。其中二苯甲酰甲烷作为亲核试剂时产物产率高达95%,ee值为98%(11i),为双羰基化合物通过不对称偶联过程得到1,4-二羰基化合物提供了新的策略,也为酮类化合物的对映选择性烷基化提供了新方法。该反应得到的产物还能再转化为相应的酮化合物(图6)。作者利用Et3N•3HF消除TBS保护基可避免产物外消旋化,对映选择性得到很好地保持。
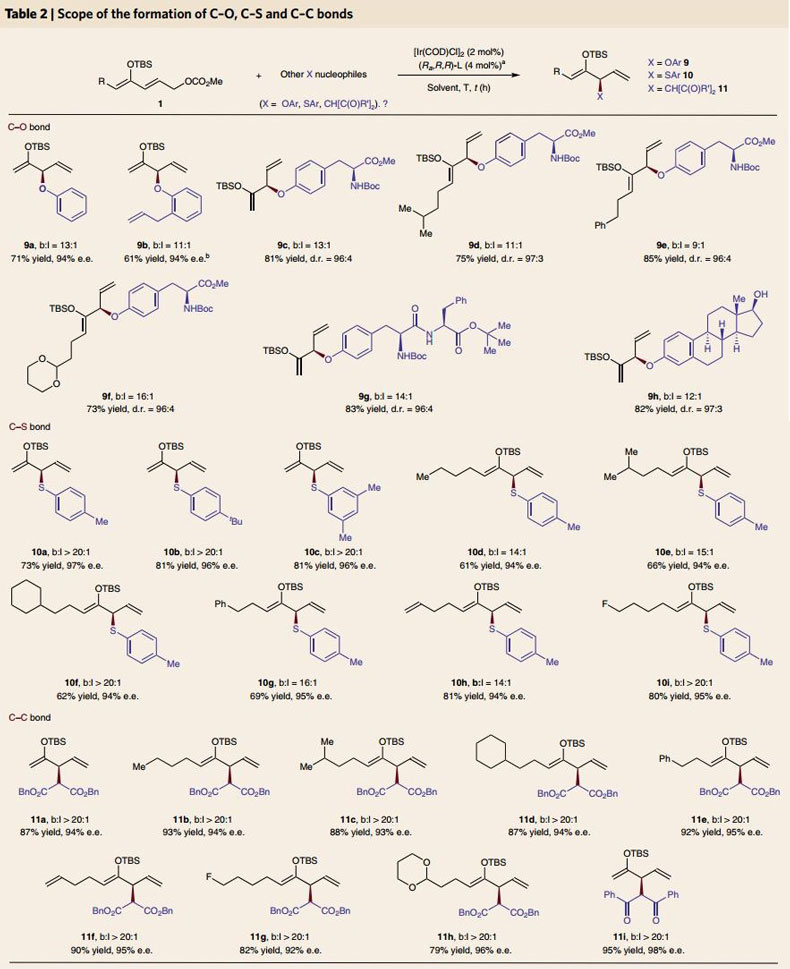
图5. 铱催化条件下利用含有烯丙基酯的酮衍生物构建C-O、C-S和C-C键。图片来源:Nat. Chem.

图6. 铱催化烯丙基取代反应产物的选择性转换。图片来源:Nat. Chem.
总结
John F. Hartwig教授提出利用铱催化的烯丙基取代反应在酮羰基α位对映选择性地构建C-N、C-S、C-O和C-C键的新方法。羰基在TBS保护基修饰下可与多种亲核试剂发生烯丙基取代反应,比如一级和二级烷基胺、芳基胺、苯氧基盐、硫酚盐、丙二酸盐和1,3-二酮化合物。所有亲核试剂可在同一催化体系下顺利参与反应,与传统利用亲电试剂对酮进行选择性α-官能化的方法相比,氮、氧、硫及碳等亲核试剂无需转化为相应的亲电试剂,可直接参与反应,由此拓展了底物的适用范围。许多天然小分子也可以参与该反应,如氨基醇、氨基酸和多肽。该方法为实现酮类化合物的α-官能化提供了一种有效而通用的策略。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantioselective α-functionalizations of ketones via allylic substitution of silyl enol ethers
Nat. Chem., 2019, DOI: 10.1038/s41557-018-0165-x
导师介绍
John F. Hartwig
https://www.x-mol.com/university/faculty/40
参考资料:
(本文由Sunshine供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号