知否知否,应是 Excel 动力学分析
目视动力学分析是指通过人眼目视比较的方法,从由实验数据得到的反应进程曲线中获取有价值的反应机理信息。通过这种方法,只需几次实验即可方便快速地获取反应的基本动力学信息。
近日,英国皇家化学会旗舰期刊Chemical Science发表了英国曼彻斯特大学Jordi Burés课题组的短篇综述 (Minireview),细致地介绍了过去十五年间发展起来的目视动力学分析法,并对初学者最常见的问题提供了解答。此外该篇综述还附带了一个视频教程,详细介绍了若干个 VTNA 和 RPKA 的实际 Excel 操作(后文附上了指导教程,视频配有中文字幕,供您参考)。
Visual kinetic analysis
Christian D.-T. Nielsen and Jordi Burés*
Chem. Sci., 2019, 10, 348-353
http://dx.doi.org/10.1039/C8SC04698K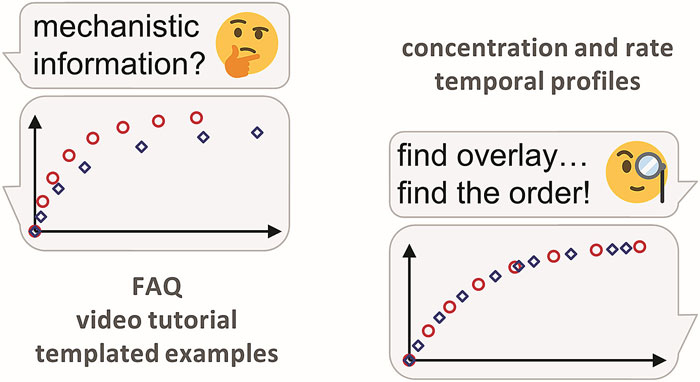
本报道部分内容参考:张恒, 汪存信. 介绍一种处理动力学数据的新方法. University Chemistry, 2009, 24(6): 65-67.
本报道以及教学视频内的中文字幕是基于本篇 Chem. Sci. 论文以及相关资料进行的创作,我们已尽最大努力确保内容的准确性、可读性、易理解性,但限于水平,难免可能有所纰漏,欢迎大家批评指正 (o゚ω゚o)
背景介绍
化学反应速率
化学反应速率是指表示化学反应进行的快慢。平均速率通常以单位时间内反应物或产物浓度的变化(减少值或增加值)来表示;随着反应的进行,产物的浓度增加,反应物的浓度减少。
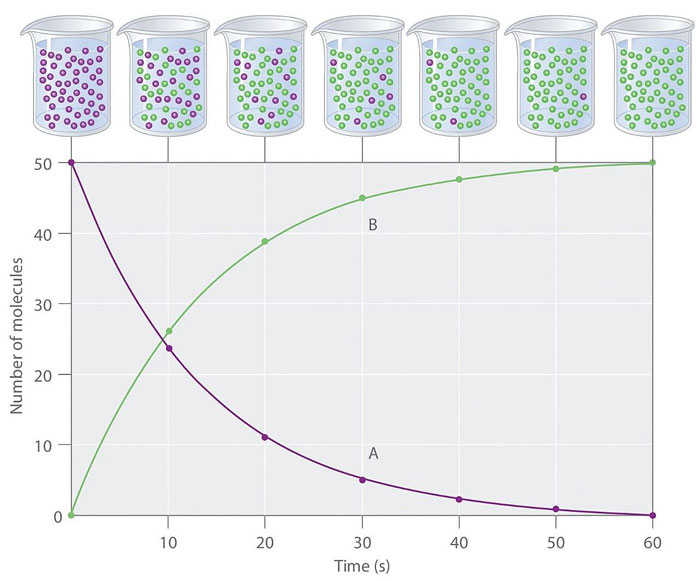
一个化学反应过程中反应物与生成物浓度随时间的变化曲线,即 c(t)-t 曲线 Source: The LibreTexts libraries
平均反应速率的大小与反应的进程以及时间量程(两个时间点的间隔)有关。开始时反应物较多,单位时间反应浓度减小得较快,产物浓度增加也较快,也就是反应较快;在反应后期,反应物变少,单位时间内反应物浓度减小得较慢,产物浓度增加也较慢,也就是反应速率较慢。
在实际工作中,通常测量反应的瞬时反应速率;某反应时刻 t 时的瞬时反应速率,就是 c(t)-t 曲线上时刻为 t 时该曲线的斜率。
速率方程
化学反应速率方程是利用反应物浓度或分压计算化学反应的瞬时反应速率的方程。对于一个化学反应 A + B → 产物,化学反应速率方程的一般形式写作如下的形式:
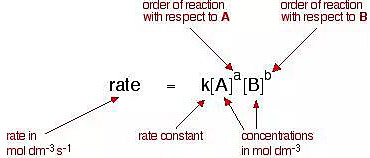
其中,[A] 和 [B] 分别代表反应物 A 和 B 在当时的活度,其在实际计算中也常用浓度代替(若反应物为气体则用分压表示);
k 表示这一反应的速率常数 (rate constant),其与温度、离子活度、光照、固体反应物的接触面积、反应活化能等因素有关,通常可通过阿累尼乌斯方程计算出来,也可通过实验测定;
指数 a、b 为反应级数 (order of reaction; reaction order),在基元反应中反应级数等于化学计量数,但在非基元反应中两者不一定相等。
反应级数的目视确定
在表观动力学研究中,确定反应级数是一个很重要的环节。从反应级数可以得到动力学方程、推测反应机理、分析反应历程,有助于对反应的深入研究。在确定反应级数的传统方法中,有些虽然只需要较少的实验数据,但可能得不到准确的结果;有些虽然可以得到准确的结果,但实验的工作量往往较大。
目视动力学分析 (Visual kinetic analysis) 是指通过人眼目视比较的方法,从由实验数据得到的反应进程曲线中获取有价值的反应机理信息。通过这种方法,只需几次实验就可方便快速地获取反应的基本动力学信息。
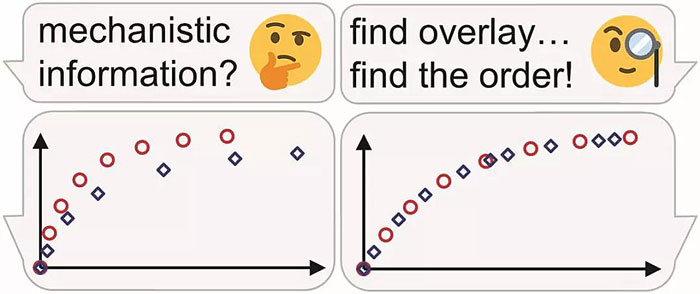
目视动力学分析法的精髓在于寻找到合适的参数,从而使两个反应的反应曲线重合(目视判断即可);在 Excel 等数据可视化软件的帮助下这一点已可以轻松实现(详见下文叙述)。
从形式上来说这是一种图形化方法;图形化方法由于具有直观的优点在处理动力学数据中得到广泛应用。较简单的分析过程、完整的反应信息、更少的实验次数、更好的数据呈现使目视动力学分析法非常适用于对于动力学通常不是很擅长的有机化学家,而该分析法所提供的表观动力学数据也为有机化学家研究反应机理提供了重要线索。
这种方法的可行性直接取决于实验的监测手段,只有能够提供大量准确数据的原位在线的测量手段才能与该种动力学分析法匹配。快速发展的现代仪器技术所提供的波谱(红外、紫外、核磁、拉曼等)、量热等数据正好可以满足这个要求。此外,对于原位测量仪器产生的大量实验数据,Excel 等数据处理软件的大规模普及已为这种动力学分析法的应用提供了有效的数据处理和呈现手段。

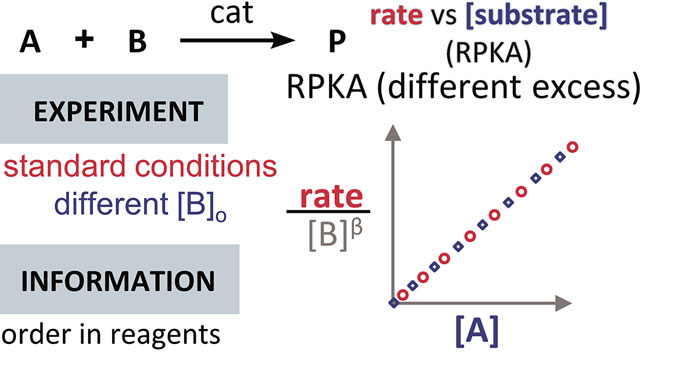
速率浓度图 — RPKA
英国帝国理工学院(现任职于美国斯克里普斯研究所)Donna G. Blackmond 教授提出了一种处理动力学数据的新方法——反应进程动力学分析法 (Reaction Progress Kinetic Analysis, RPKA)。这种方法只需要较少的接近真实实验条件的实验,不需要大大过量的实验就可以得到反应级数,此外还可以提供有关催化剂激活和失活、产物抑制等信息。

Donna G. Blackmond 教授(图片来源:www.scripps.edu)
超额浓度 [e]
以式下面的反应式所示的两底物反应为例(A、B 为反应物,cat 为催化剂,P 为产物),
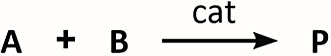
反应物 A 每消耗一个分子,反应物 B 必然也消耗一个分子,也就是在反应过程中任一时刻,必然满足下面的数学式,
[B]0 − [B]t = [A]0 − [A]t
其中 [A]0、[B]0 分别为反应物 A 和 B 的起始浓度,[A]t、[B]t 分别为反应物 A 和 B 在该时刻的瞬时浓度。
可以如下通式所示定义一个超额浓度 (excess) [e],
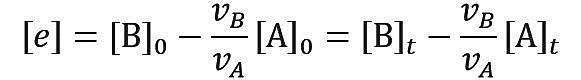
其中 vA 和 vB 分别为反应物 A 和 B 的化学计量系数;上例中 vA 和 vB 均为 1。
判断是否存在产物抑制或催化剂失活
判断是否存在产物抑制或催化剂失活时,比较的是起始点不同、超额浓度相同的两个反应所获得的「反应速率 vs 底物浓度」曲线(下图中红色和绿色的两个反应),如下图所示。请注意,随着反应的进行反应物的浓度是不断降低的,因此初始浓度 [A]₀ 是对应曲线上最右侧的点,反应的进程是横坐标从右到左。
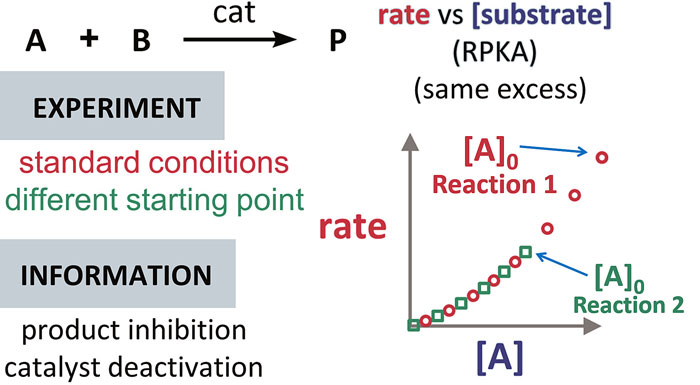
两个反应中起始物质的初始浓度虽然不同,但若这两个反应中既不存在产物抑制也不存在催化剂失活的情况,那么反应物初始浓度更高的那个反应(上/下图中红色点)在某个时间点时各反应物的瞬时浓度,会与反应物初始浓度更低的那个反应(上/下图中绿色点)相同;也就是说,此时这两条曲线是可以相互重合的。
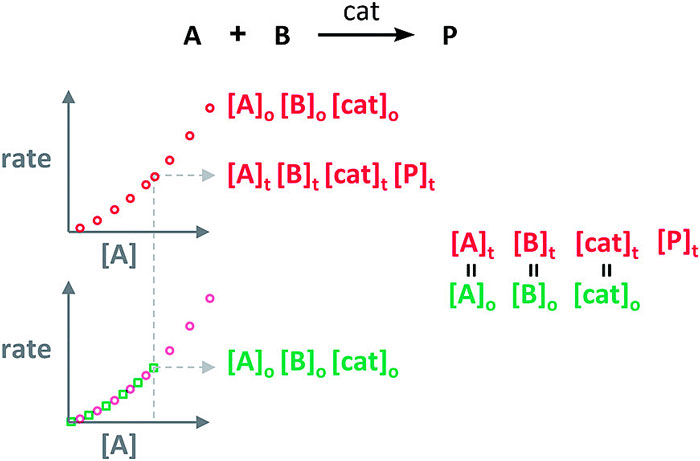
如果两条曲线不重合,那么就说明反应中存在产物抑制或催化剂失活的情况。
确定催化剂的反应级数
在利用 RPKA 方法获得催化剂的反应级数信息的过程中,对催化剂载量不同的两个反应进行作图(下图),以底物浓度(下图中为 [A])为横坐标值、速率/[cat]Tγ 为纵坐标值。使这两条反应曲线重合的 γ 值就是该反应中催化剂的反应级数。
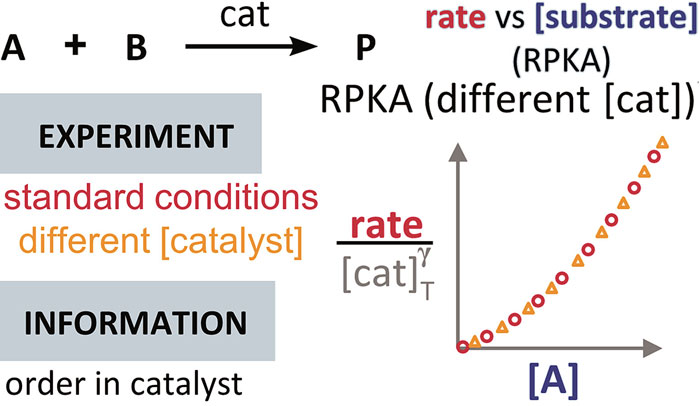
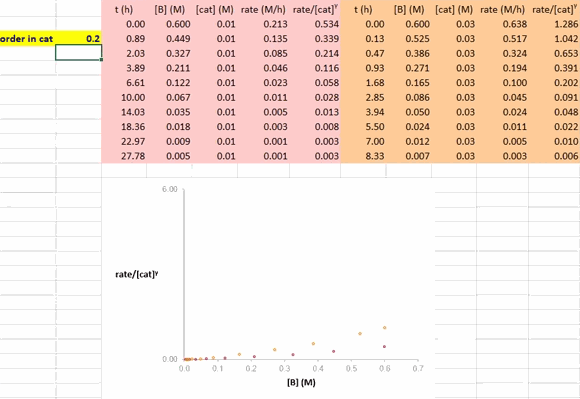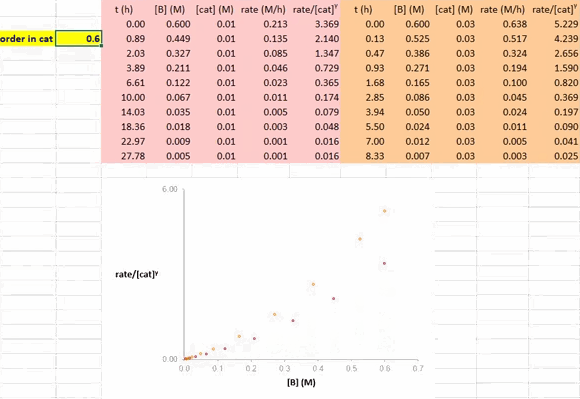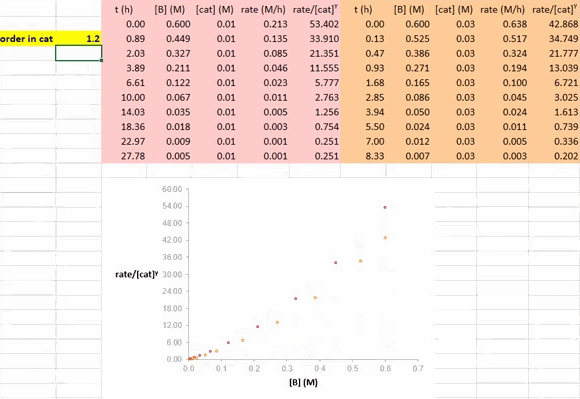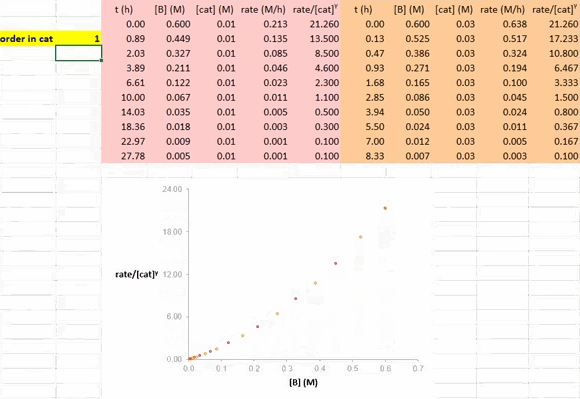
在 Excel 软件中调整 γ 值后,两条反应曲线可以实时更新;能使这两条反应曲线重合的 γ 值就是催化剂的反应级数(具体可见后文提供的教学视频)。
确定反应物的反应级数
对于反应 A + B → P(含催化剂 cat),在利用 RPKA 获得反应物(以 B 为例)的反应级数时,进行两组不同的实验,其中反应物 A 和催化剂 cat 的初始浓度都相同,反应物 B 的初始浓度不同(如此这两组实验的超额浓度就不相同了)。以反应物 A 的浓度为横坐标值、速率/[B]β 为纵坐标值进行作图。
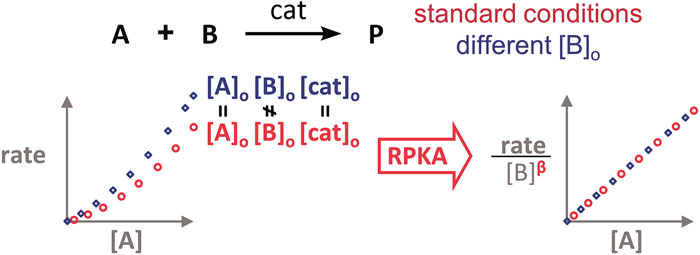
使这两条反应曲线重合的 β 值就是反应物 B 的反应级数。如果得到的曲线是直线,则还可确定反应物 A 的反应级数为 1(即满足方程 rate/[B]β = k[A] ⇒ rate = k[A]1·[B]β)。
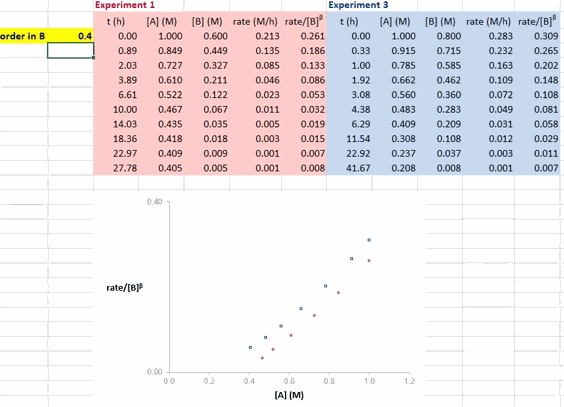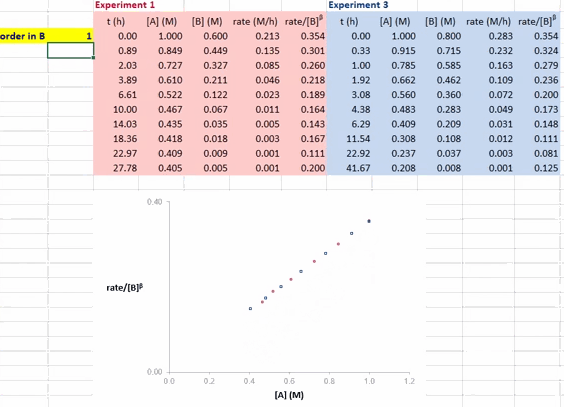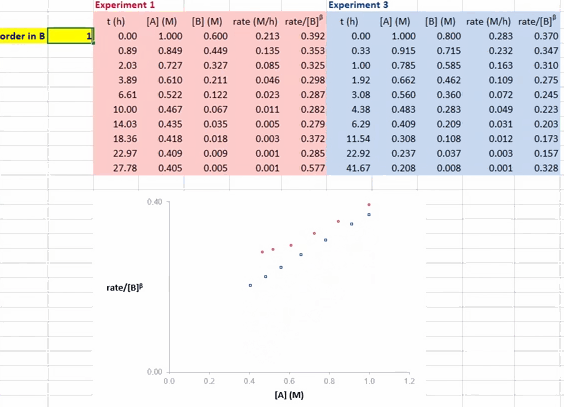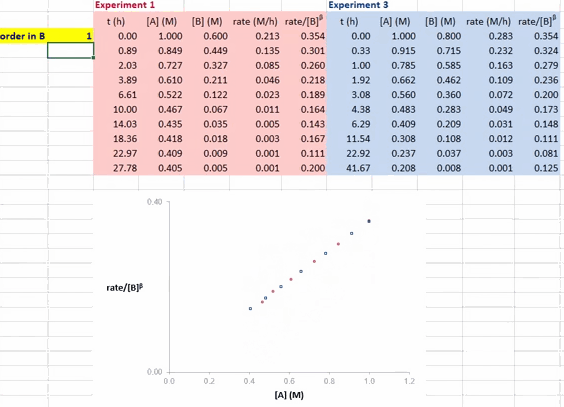
在 Excel 软件中调整 β 值后,两条反应曲线可以实时更新;能使这两条反应曲线重合的 β 值就是反应物 B 的反应级数(具体可见后文提供的教学视频)。
浓度时间图 — VTNA
时间变量的归一化分析 (Variable Time Normalisation Analysis, VTNA) 是按时间对浓度数据进行作图。现代的反应监测手段,例如 NMR、FTIR、UV、拉曼、GC 和 HPLC 等都可以直接获得浓度数据。通过比较不同反应的浓度-时间曲线,可以确定产物抑制或催化剂失活、催化剂的反应级数以及各反应物的反应级数。
判断是否存在产物抑制或催化剂失活
判断是否存在产物抑制或催化剂失活时,比较的是起始点不同、超额浓度相同的两个反应所获得的「底物浓度 vs 反应时间」曲线(下图中红色和绿色的两个反应)。
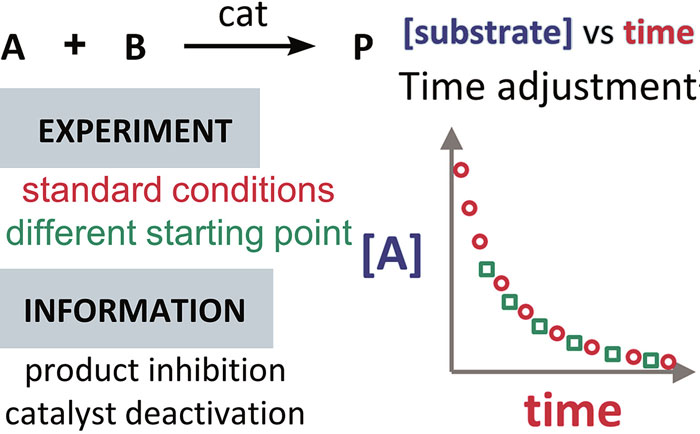
请注意,对于反应物起始浓度较低的那个反应,需要将其曲线上的各点向右平移相同的距离,以使起始点的位置与另一个反应的曲线重合。
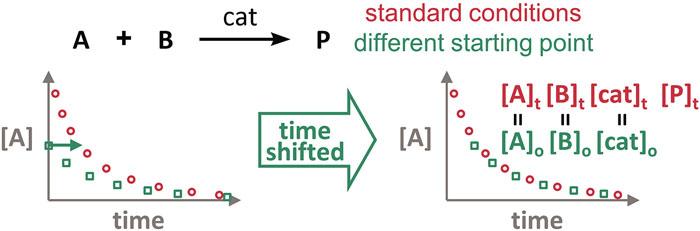
如果上述两个反应进度曲线重合,则表明此反应既不存在催化剂失活,也不存在产物抑制。若不重叠,则表明存在催化剂失活或产物抑制。
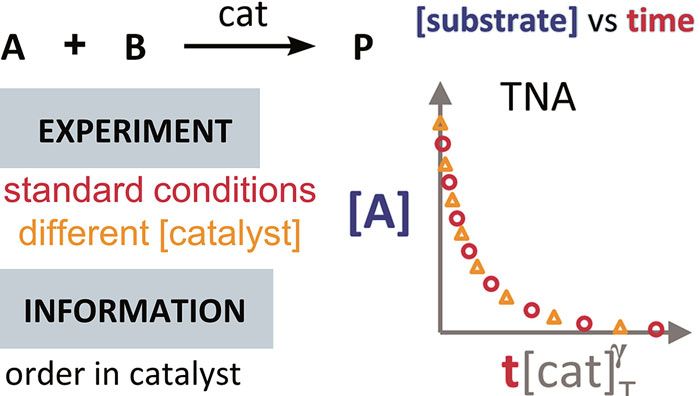
确定催化剂的反应级数
在利用 VTNA 方法获得催化剂的反应级数信息的过程中,以 Σ[cat]γΔt 值为横坐标、底物浓度(下图中为 [A])为纵坐标值,对催化剂载量不同的两个反应进行作图(下图)。
其中 Σ[cat]γΔt 的定义如下;若活性催化剂的浓度在整个反应过程中保持不变,该式也可以简化为 t[cat]ot。
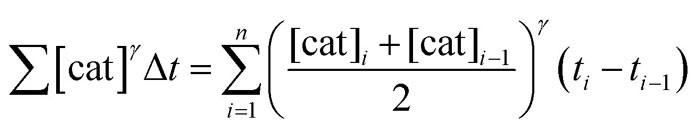
使这两条反应曲线重合的 γ 值就是该反应中催化剂的反应级数(注意与上图不同的是,此动图使用的是产物的浓度数据)。
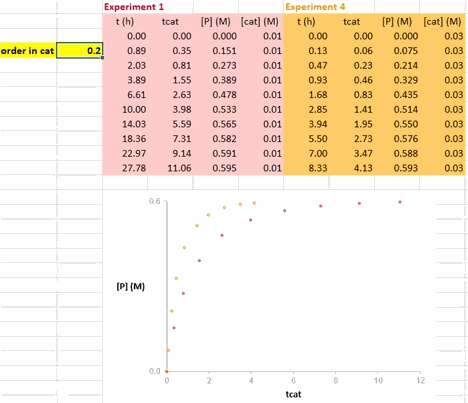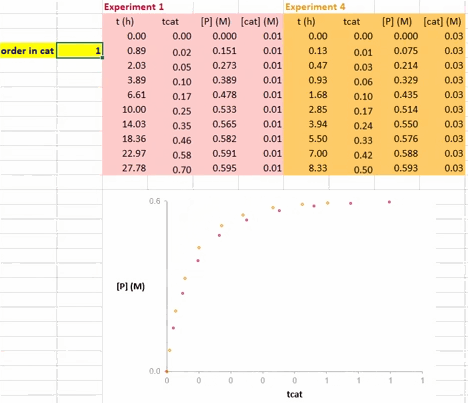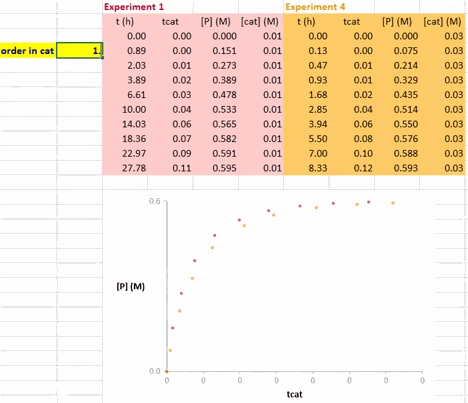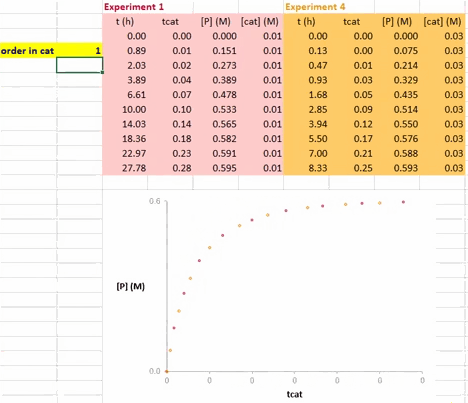
在 Excel 软件中调整 γ 值后,两条反应曲线可以实时更新;能使这两条反应曲线重合的 γ 值就是催化剂的反应级数(具体可见后文提供的教学视频)。
确定反应物的反应级数
对于反应 A + B → P(含催化剂 cat),在利用 VTNA 获得反应物(以 B 为例)的反应级数时,进行两次不同的实验,其中反应物 A 和催化剂 cat 的初始浓度都相同,反应物 B 的初始浓度不同(如此这两组实验的超额浓度就不相同了)。以反应物 A 的浓度 [A] 为纵坐标值、Σ[B]βΔt 为纵坐标值,对这两组反应进行作图。
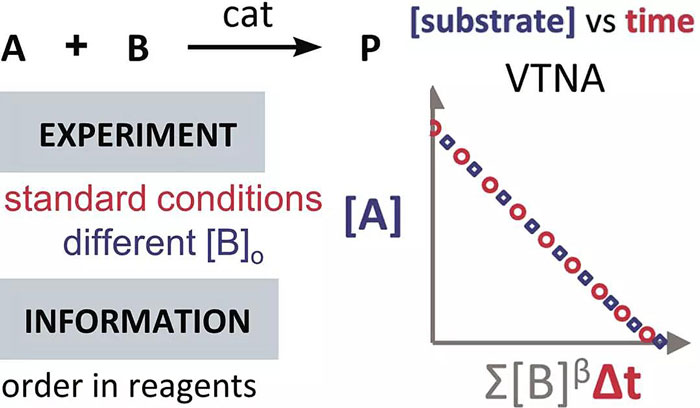
其中 Σ[B]βΔt 的定义如下:
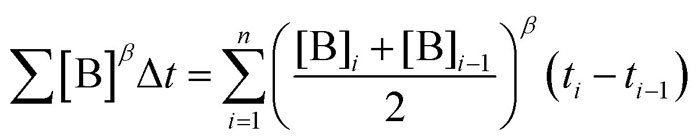
使这两条反应曲线重合的 β 值就是该反应物的反应级数(注意与上图不同的是,此动图使用的是反应物 B 的浓度数据)。
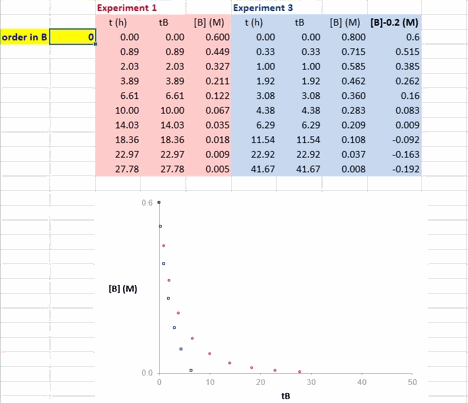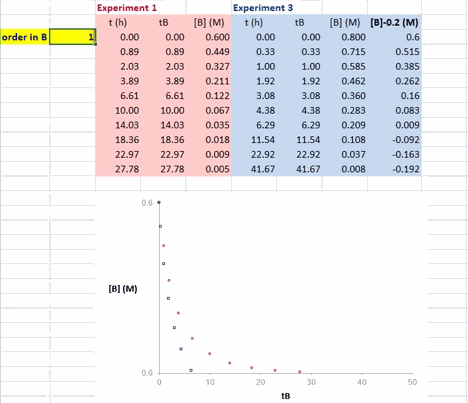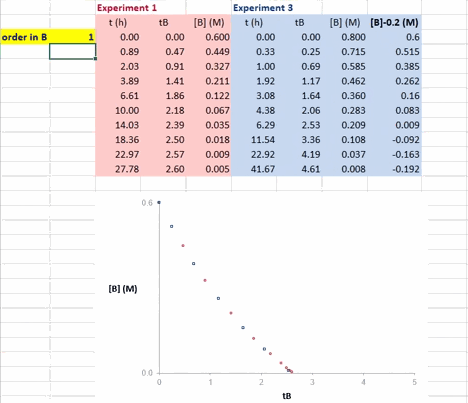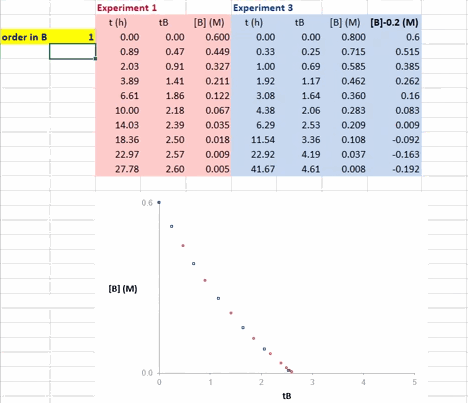
在 Excel 软件中调整 β 值后,两条反应曲线可以实时更新;能使这两条反应曲线重合的 β 值就是反应物 B 的反应级数(具体可见后文提供的教学视频)。
视频教程
以下是本文作者录制的视频教程,小编在此配上了中文字幕以方便大家收看(中文字幕仅供参考)。由于手机屏幕较小,建议手机横屏播放 <(‵▽′)>,或者用电脑打开,选择高清 (720p) 分辨率进行收看。
作者简介

英国帝国理工学院
获得英国帝国理工大学硕士学位,期间在新加坡南洋理工大学化学和生物化学系 Jianrong(Steve) Zhou 教授课题组交流学习。目前正在攻读博士学位,导师为 Jordi Burés、Alan Spivey 和 Klaus Hellgardt,博士课题的研究方向为利用工程手段解决化学问题。

Jordi Burés
英国曼彻斯特大学
获得西班牙巴塞罗那大学博士学位,随后在美国斯克里普斯研究所 (The Scripps Research Institute) Donna Blackmond 教授课题组进行博士后研究。2013 年加入英国伦敦帝国理工学院,2016 年加入曼彻斯特大学。研究方向为利用机理研究改良有机化学反应过程以及新反应的开发。
关于 Chemical Science

Chemical Science
IF: 9.063 *
英国皇家化学会旗舰期刊,发表化学领域最前沿、最重要、最具挑战性的高影响力研究成果。

如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号