中科院上海有机化学研究所唐功利研究员近年来工作简介——复杂天然产物生物合成
唐功利研究员简介:
1994年毕业于南开大学,获环境化学学士学位,1999年获中国科学院上海有机化学研究所生物有机化学博士学位,毕业后赴美国University of California-Davis从事博士后研究,2001-2003年在University of Wisconsin- Madison任研究助理;2003年作为中国科学院“百人计划”引进人才,被聘为中国科学院上海有机化学研究所生命有机化学国家重点实验室研究员;2004年获得国家杰出青年基金,入选上海市科技启明星(2005)及启明星跟踪计划(2008)资助;2014年入选上海市优秀学术带头人及科技部中青年科技创新领军人才;2015年入选国务院特殊津贴专家;2016年入选中组部万人计划-中青年科技创新领军人才,同年入选上海市领军人才;课题组主要从事微生物源复杂天然产物的生物合成、化学生物学及合成生物学的相关研究;目前已在Nat. Commun.、Proc. Natl. Acad. Sci. USA、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Org. Lett.、Chem. Biol.、J. Biol. Chem.、ACS Chem. Biol. 等期刊发表论文70余篇,申请专利15项(其中授权9项);已培养博士28人(其中联合培养7人),联合培养硕士23人,出站博士后4人。

唐功利研究员团队近年来复杂天然产物生物合成的代表性工作简介如下:
(一)海洋天然产物越野他汀生物合成中独特的蒽环羟基区域异构化
芳香聚酮类化合物是自然界广泛存在的天然产物,其中蒽环类化合物作为广泛应用的抗癌药物之一,得到基础研究和临床研究者的广泛关注。但蒽环类化合物普遍具有心脏毒性等毒副作用,因此迫切需要开发新的蒽环类药物来满足临床应用。唐功利课题组长期以来致力于复杂结构、抗肿瘤天然产物的生物合成及组合生物合成的研究。越野他汀(Kosinostatin,KST)是由海洋小单孢菌产生的、具有独特螺环结构的蒽环天然产物,具有显著的抗肿瘤活性。他们在前期的工作中克隆了生物合成基因簇,提出了由非核糖体肽合成酶(NRPS)和系列后修饰合成的氮杂双环模块与II型聚酮合酶(PKS)及后修饰合成的1-OH蒽环中间体在酶作用下以螺环偶联起来,再经过糖基化完成KST的汇聚式生物合成途径。随后的研究表明,KST的PKS-II催化合成的是典型的4-OH蒽环中间体,而和氮杂双环偶联的必须是1-OH蒽环中间体,由此推测其生物合成中包含一个芳香环C-4到C-1的羟基位置异构反应。该课题组通过体内遗传结合体外生化,并与该所生命有机化学国家重点实验室的潘李锋研究员课题组合作,通过关键去芳香化酶KstA11与底物及辅因子复合物的结构解析成功揭示了自然界如何实现蒽环上芳香环的羟基区域异构化问题。首先双酶体系KstA15/A16催化化合物3的对位羟化产生1,4-双羟基化合物5;在KstA11作用下5异构化为5a,随后发生H的1,4加成产生6a;6a在反应体系中自发或者在KstA10诱导下异构化为较稳定的6b,KstA10催化6b的4位C=O还原及脱水重新芳构化得到化合物4。该四酶协同体系依次催化蒽环区域选择性羟化-不对称还原去芳香化-区域选择性还原脱水重新芳构化,相关酶催化反应的发现及酶学机制的阐明为进一步蒽环抗生素的代谢工程改造及生物催化体系的拓展奠定了基础(Proc. Natl. Acad. Sci. USA, 2017, 114, 1554)。
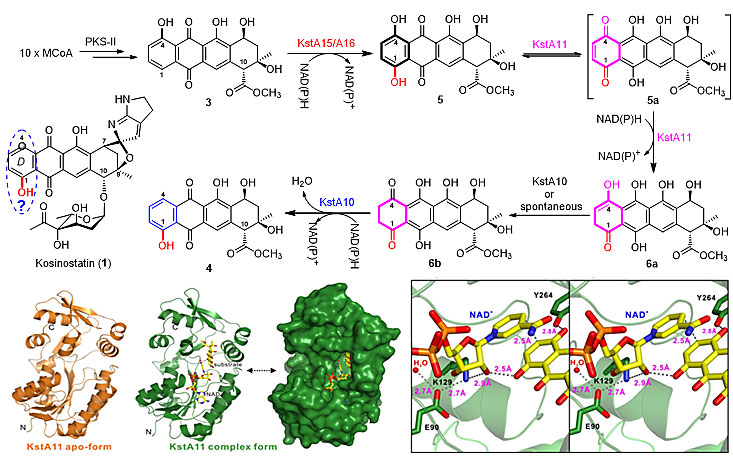
图1. 越野他汀(Kosinostatin)的生物合成途径中四个酶催化的羟基区域异构化
(二)桥二酮哌嗪生物碱双环霉素的生物合成途径与酶催化多步C-H键活化成环
双环霉素(Bicyclomycin,BCM)是氧杂桥环二酮哌嗪类抗生素,具有显著的抗革兰氏阴性菌活性,且作用靶点非常特殊,是天然产物中已知唯一的转录终止因子Rho蛋白的选择性抑制剂。BCM结构中包含天然产物中少见的[4,2,2]-氧杂桥环二酮哌嗪骨架、三羟基基团和环外亚甲基。作为一种具有桥环三维结构、脂肪链高度氧化修饰的活性天然产物,BCM吸引了有机合成和生物合成领域的关注。该课题组采用体外重构所有酶催化反应的策略,全面解析了BCM的生物合成路径,包括1个环二肽合酶BcmA、5个非血红素铁依赖的双加氧酶BcmB/C/E/F/G和1个细胞色素P450单加氧酶BcmD。他们从环二肽合酶出发,对各酶的功能进行了逐步、逐个地验证,并分离鉴定了几乎所有酶催化的中间产物,最终成功地在体外重现了完整的BCM生物合成途径,同时也阐明了该途径中所有酶的催化功能。BCM的生物合成过程包括连续多步的惰性C-H键活化以及在C-H键活化基础上的一步脱氢-环氧化-桥环形成过程(BcmB)。相关成果发表于《德国应用化学》(Angew. Chem. Int. Ed., 2018, 57, 719)。该研究不仅可以为这类自然界稀有的天然产物创造结构多样性,有助于新型抗耐药菌药物前体的发现,还能够提供8元氧杂桥环构筑的新途径和惰性C-H键活化的新方法。
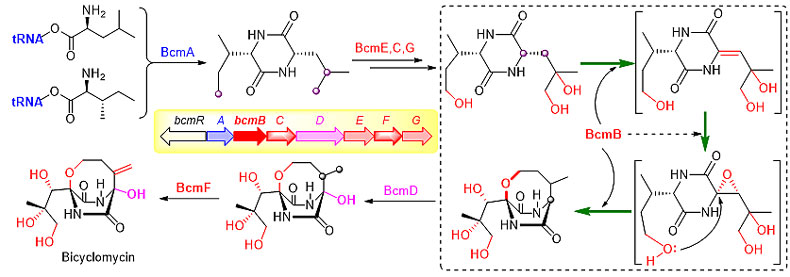
图2. 双环霉素(Bicyclomycin)的生物合成研究
(三)高活性抗肿瘤苯并双吡咯生物碱生物合成中环丙基的形成
非活化碳-碳双键的环丙基化尽管在化学合成中可以通过多种方法来实现,但是该过程在天然产物的生物合成中却鲜有报道。该课题组在苯并双吡咯生物碱家族天然产物CC-1065生物合成研究过程中,阐明了由一个HemN家族蛋白(C10P)和一个甲基转移酶(C10Q)组成的双酶体系共同催化形成CC-1065中的环丙基结构。他们首先通过基因敲除发现c10P 和c10Q 都是CC-1065环丙基生物合成所必需的,并且这两个基因的突变株都能积累同一个环丙基缺失的中间体。随后他们以该中间体为底物,由重构的C10P和C10Q组成的双酶体系在严格无氧的条件下能够实现该中间体的环丙基化,从而生成CC-1065。为了探讨环丙基化的催化机理,他们还进行了关键中间体的质谱检测、CD3-SAM和D2O同位素标记实验以及关键氨基酸残基的点突变研究。其中,检测到的SAM-底物共价中间体使作者推测S-腺苷甲硫氨酸亚甲基自由基这一新颖物种的存在,并提出了该双酶体系共同催化CC-1065环丙基形成的生物合成过程。相关成果已于2018年7月17日发表在《自然•通讯》上(Nat. Commun., 2018, 9, 2771)。这种新型环丙基化机制的揭示不仅拓展了人们对HemN家族蛋白和甲基转移酶催化反应的认识,而且暗示着S-腺苷甲硫氨酸可以产生不同的自由基化学。
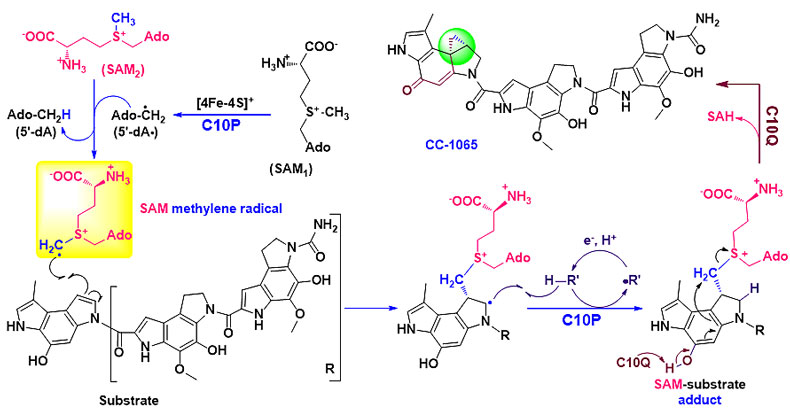
图3. HemN家族蛋白C10P和甲基转移酶C10Q共同催化形成CC-1065中的环丙基单元
(四)高活性DNA烷基化剂苯并双吡咯生物碱生物合成中的自抗性机制
CC-1065和谷田霉素(Yatakemycin, YTM)是苯并双吡咯生物碱家族天然产物的代表性成员,均可以抑制致病真菌,且对肿瘤细胞表现出极强的细胞毒活性(IC50达到pM-nM数量级)。该家族化合物典型的结构特征是吡咯吲哚环上的环丙基结构,属于DNA烷基化剂。最近的研究表明,该家族化合物不仅可以对游离的DNA双螺旋发生烷基化修饰,还可以高效地对核小体颗粒中的DNA进行烷基化修饰,甚至是几乎全部被组蛋白包围的DNA,是研究真核细胞染色体中DNA-组蛋白的动力学识别及DNA损伤导致的生物效应有力的工具。其生物活性源于分子与DNA双螺旋的小沟中畗含AT区域的识别,进而环丙基三元环活性中心对腺嘌呤A碱基发生DNA烷基化修饰引起DNA链断裂。因此,这类化合物的产生菌如何保护自身的DNA避免烷基化损伤一直是人们关注的重点之一。继之前揭示了第一例来源于微生物次生代谢的糖基水解酶参与的碱基剪切修复机制,其生理功能是参与YTM的自身抗性机制之后,该课题组在该家族天然产物的自抗性机制研究方面再获新进展。他们从YTM研究材料出发证明了YtkR7(属于GyrI-like家族蛋白)可以水解YTM的环丙基,从而起到YTM失活的目的。随后他们揭示了GyrI-like家族的一个亚家族蛋白具有水解YTM和CC-1065环丙基的特性,这也是GyrI-like家族蛋白成员首次证明有酶的活性(这类酶定义为cyclopropanoid cyclopropyl hydrolase, CCH),进而与该所生命有机化学国家重点实验室的周佳海课题组以及瑞士洛桑联邦理工学院EPFL的袁曙光课题组在晶体学和计算生物学方面展开了合作,随后提出了可能的催化机理。CCH蛋白功能的发现使人们重新审视对GyrI-like蛋白功能的认识,即生物体利用GyrI-like蛋白作为抗生素抗性蛋白可能是一种古老的现象,这类蛋白可以看作是细胞内的清道夫,隔离外源性有毒化合物以达到保护细胞的目的。因此,这项工作不仅为真核生物中GyrI-like蛋白的功能研究提供重要的借鉴作用,也为药物研发领域提供一定的参考意义。这一成果发表在《自然•通讯》上(Nat. Commun., 2017, 8, 1485)。
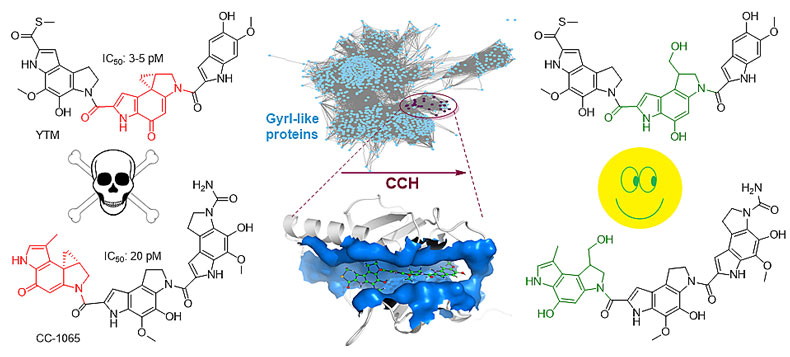
图4. YTM和CC-1065的生物合成研究揭示了全新的环丙基水解酶参与的自抗性
(五)四氢异喹啉家族生物碱生物合成中自抗性机制的深入研究
萘啶霉素(Naphthyridinomycin,NDM)是四氢异喹啉生物碱家族中最早发现的成员,具有独特而复杂的多环结构;该化合物不仅具有抗肿瘤活性,对一些临床的耐药菌还具有很强的杀伤效果。该类抗生素均具有药效官能团——半缩醛胺,其中羟基通过质子化脱水,伴随氮原子提供孤对电子形成亲电性亚胺物种,形成亚胺的碳原子易被鸟嘌呤中的N-2位亲核进攻,从而有效地烷基化DNA。NDM产生菌如何避免抗生素对自身产生伤害一直没有解决。最近,该课题组在NDM的生物合成研究过程中发现了分泌型、FAD依赖的氧化还原酶NapU在胞外氧化无活性前体生成具有生物活性的萘啶霉素,随后还可以进一步氧化萘啶霉素使其失活。首先,他们通过基因敲除发现基因napU 失活的突变株发酵产生无半缩醛胺羟基的中间体5。体外酶活测试表明:NapU能迅速氧化化合物5生成NDM (1);而随着反应时间的延长,NDM缓慢地转化为具有酰胺结构的化合物7。通过对野生型萘啶霉素产生菌发酵产物进行时间梯度监测,他们发现发酵产物NDM和化合物7的产量变化与体外酶活测试结果一致。以大肠杆菌作为测试菌,他们发现化合物5和7的活性远远低于NDM。基于这些实验结果,他们提出了这种胞外氧化活化产生抗生素和进一步氧化失活过程可能是产生菌的一种自抗性机制。随后他们通过Western-Blot和蛋白质谱方法对野生型菌株表达的分泌蛋白NapU进行捕捉和定量,而表达NapU的大肠杆菌对NDM表现出明显的抗性。相关成果近期发表在《美国科学院院报》上(Proc. Natl. Acad. Sci. USA, 2018, 115, 11232)。该研究揭示了一种原核生物罕见的“胞内药效团失活-前药外泌与成熟-胞外药效团再生-宿主周边活性抗生素浓度调控”复杂而精巧的时空隔离自抗性机制,进一步暗示了链霉菌富含复杂多样的胞外生理与生化。
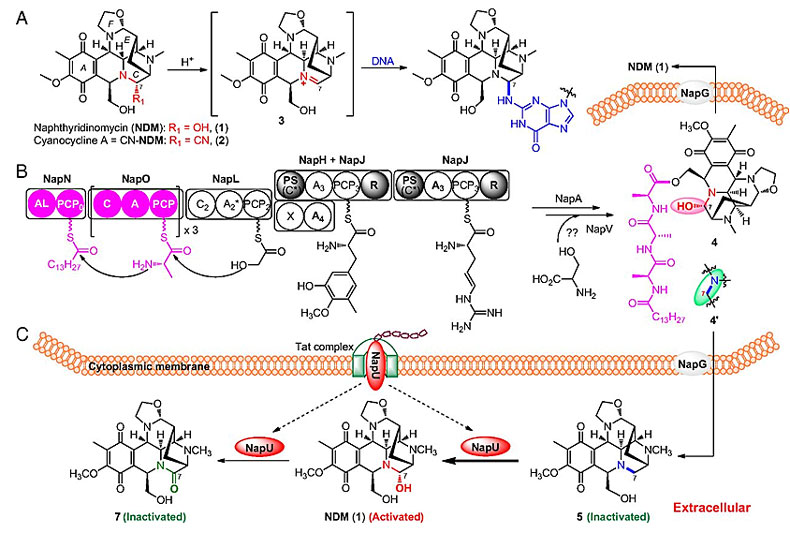
图5. 萘啶霉素烷基化DNA的机理、萘啶霉素的生物合成途径和胞外活化-失活
以上内容为唐功利研究员课题组近两年来具有代表性的工作成果,其它更多详细的信息请参考该课题组的网站(http://tanggl.sioc.ac.cn )或发送邮件至gltang@sioc.ac.cn进一步讨论。此外,该课题组欢迎有志于科研,并对其研究方向感兴趣的同学联系报考硕士/博士以及博士后岗位。
导师介绍
唐功利
https://www.x-mol.com/university/faculty/15570
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号