北京大学雷晓光课题组在对映-贝壳杉烷四环二萜天然产物全合成领域取得重要进展
对映-贝壳杉烷类(ent-kaurane)二萜是一大类具有抗菌、抗病毒、抗肿瘤等多种重要生物活性的四环二萜天然产物,目前已有超过1000成员被分离、鉴定出来。由于复杂的结构和潜在的生物活性,该类型天然产物吸引了合成化学家的广泛关注。国内外众多著名的有机化学家都对该类分子进行了合成研究,目前报道的合成方法大都需要多步构建其四环骨架,尤其是[3.2.1]双环骨架。
北京大学雷晓光(点击查看介绍)课题组近日在对映-贝壳杉烷类(ent-kaurane)天然产物的合成上取得了重要进展。他们发展了一种简洁高效地构建对映-贝壳杉烷类(ent-kaurane)四环骨架的方法:通过利用北京大学余志祥课题组前期发展的铑催化的Yu-[3+2+1]环加成反应构建6/6/6三环骨架,进而结合最新发展的钯介导的环烯化(cycloalkenylation)反应构建[3.2.1]双环骨架。底物普适性研究表明该两步策略可用于快速构建不同取代的对映-贝壳杉烷(ent-kaurane)骨架和对映-贝叶烷(ent-beyerane)骨架。基于该策略,他们分别以10步和8步完成了ent-1α-hydroxykauran-12-one 和12-oxo-9,11-dehydrokaurene 的无保护基高效全合成,并且以10步完成了12α-hydroxy-9,11-dehydrokaurene的全合成,并对其结构进行了修正。该合成策略不仅能够应用于对对映-贝壳杉烷类(ent-kaurane)天然产物的高效全合成,并有望应用于天然产物类似物的高效合成,从而促进进一步的化学生物学研究。该成果以在线发表在 Journal of American Chemical Society 杂志上,雷晓光课题组博士生王进和洪本科博士为文章共同第一作者。该工作得到国家自然科学基金、科技部重点研发计划、北京市卓越青年科学家项目、以及北大-清华生命联合中心的资助。
如表1所示,作者首先以8a为模型底物对铑催化的Yu-[3+2+1]环加成的反应条件进行了系统优化,8a 可从商业可得的烯酮9 经Michael 加成(Nat. Chem., 2012, 4, 649-654)和炔基化两步获得。作者发现,以 20 mol% 的[Rh(CO)2Cl]2作为催化剂,甲苯为溶剂,8a能与一个大气压的CO在80 ℃发生Yu-[3+2+1]环加成反应,从而以52%的收率 和5.2:1 的 dr 获得目标产物7a。该反应可以一步构建两个环系,三根碳碳键和一个季碳中心,非常高效。
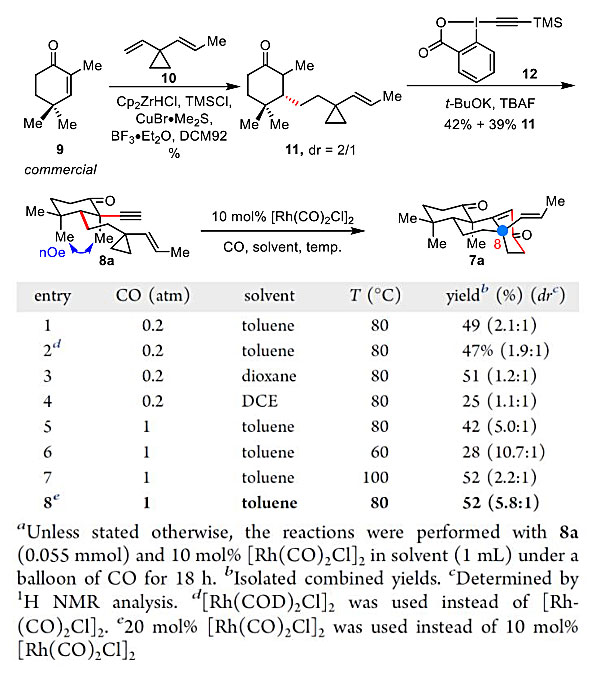
表1. [3+2+1]反应条件优化。图片来源:J. Am. Chem. Soc.
紧接着,作者以7a作为模型底物,对Pd介导的环烯化反应进行了优化。尽管类似的反应在5-烯丙基烯醇硅醚前体上被广泛研究,但过渡金属介导的5-烯基烯醇硅醚前体的5-endo氧化环化尚无文献报道。由于从7a制备的 TMS和TBS烯醇硅醚在Pd(OAc)2作用下仅得到了脱保护产物,作者随即制备了更为稳定的TIPS烯醇硅醚。经过对反应体系的系统研究和深入分析,作者发现,改变溶剂可以极大地抑制Saegusa氧化产物15的生成,而降低温度和提高Pd(OAc)2当量可以减少分子内Diels-Alder产物16的生成。最终7a在DBU和TIPSOTf作用下原位生成烯醇硅醚13,再与5倍当量的Pd(OAc)2在1,4二氧六环中室温反应,以75%分离收率得到目标产物14a。作者首次实现了通过Pd-介导5-烯基烯醇硅醚氧化环化来构建[3.2.1]环骨架。
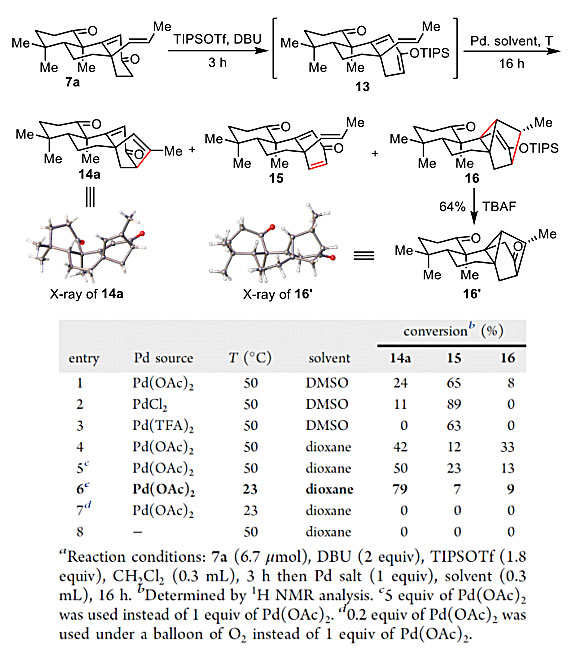
表2. Pd介导的环烯化反应条件优化。图片来源:J. Am. Chem. Soc.
在获得了最优反应条件后,作者对这两步反应策略(Yu-[3+2+1]反应/环烯化反应)的底物普适性进行了研究。对于Yu-[3+2+1]来说,C-1具有不同氧化态和烯基上具有不同取代基的烯基环丙烷前体均能以中等收率和可接收的dr值得到产物(7a-7f)。具有两个羟基的高氧化态底物7g 同样可以耐受,表明该反应能够运用到高氧化态ent-kaurane骨架的合成中。对于Pd介导的环烯化反应来说,A环和C-17位具有不同氧化态的ent-kaurane骨架都可以通过该反应高效生成(14a-14c),有趣的是,ent-beyerane骨架可以通过同样的策略从7a的非对映异构体获得(14d)。这些结果说明该两步策略可以应用于合成多样的ent-kaurane天然产物骨架。
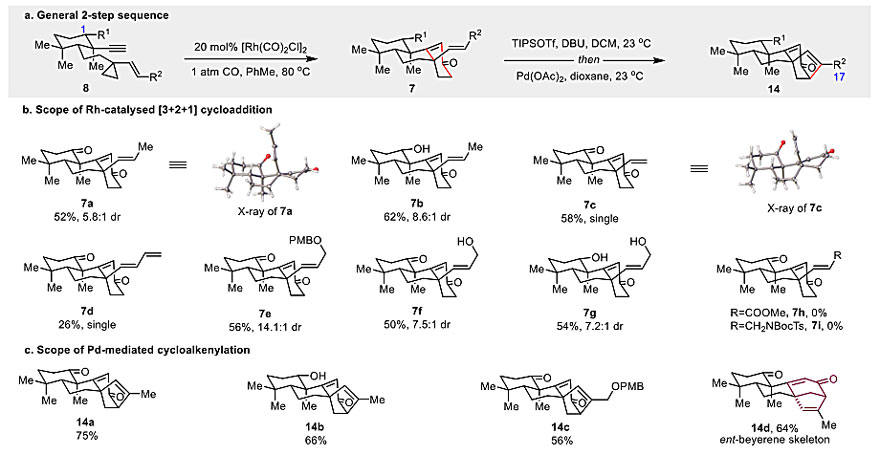
图1. 底物范围。图片来源:J. Am. Chem. Soc.
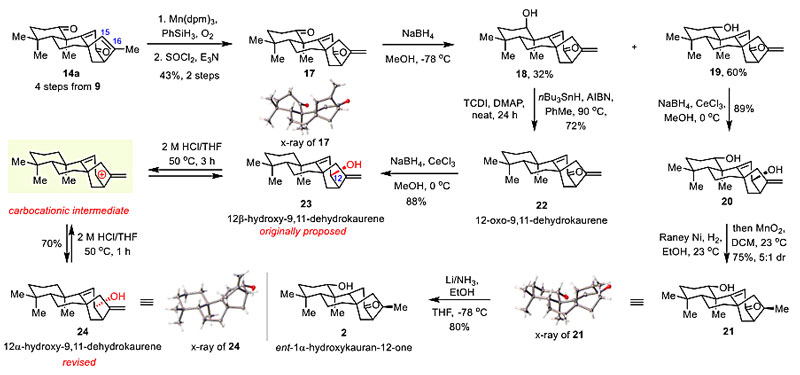
图2. ent-kaurane天然产物的高效合成与结构修订。图片来源:J. Am. Chem. Soc.
在完成快速合成ent-kaurane骨架的方法构建后,作者将其应用于ent-kaurane天然产物的合成中。ent-1α-hydroxykauran-12-one(2)是1997年被分离出的具有抗肿瘤活性的天然产物。显然,,从14a合成2的最大的挑战是如何通过选择性还原C15-C16双键从而获得正确的C16立体化学。然而,对于该三取代双键的直接还原和异构化都无法成功。作者通过Mukaiyama水化和脱水成功得到环外双键17。17通过NaBH4还原得到18和19两个异构体。19通过进一步的还原、羟基诱导的立体选择性还原,烯丙基氧化即可得到具有正确C16甲基立体化学的烯酮21, 随后经过birch还原即以10步完成了ent-1α-hydroxykauran-12-one(2)的全合成。同时,18经过Barton−McCombie 脱氧化反应即可得到天然产物12-oxo-9,11-dehydrokaurene (22)。22通过luche还原后得到了文献报道的天然产物12β-hydroxy-9,11-dehydrokaurene(23)。不幸的是,合成的23与文献报道的核磁谱图并不一致,尤其是H-12的位移(Δδ = 0.41),暗示着天然产物的12-OH手性和23可能不同。随后作者发现,23在酸性条件处理下能够以70%的分离收率到目标天然产物24,24与天然产物的核磁谱图一致并通过X-ray单晶衍射确定了结构。因此,作者将该天然产物的结构修订为12α-hydroxy-9,11-dehydrokaurenene。
小结
雷晓光课题组发展了一种简洁高效地构建ent-kaurane核心骨架的方法:通过铑催化的Yu-[3+2+1]环加成反应构建6/6/6三环骨架以及钯介导的环烯化(cycloalkenylation)反应构建[3.2.1]双环骨架。底物普适性研究表明该两步策略可用于快速构建不同取代的对映-贝壳杉烷(ent-kaurane)骨架。基于该策略,他们分别以10步和8步完成了天然产物ent-1α-hydroxykauran-12-one 和12-oxo-9,11-dehydrokaurene 的全合成,并且以10步完成了12α-hydroxy-9,11-dehydrokaurene的全合成和并对其结构进行了修正,合成中没有使用任何的保护基。通过对反应前体的精细调控,该合成策略不仅能够应用于不同对映-贝壳杉烷类(ent-kaurane)天然产物的高效全合成,并有望应用于天然产物类似物的高效合成。该工作的完成也进一步阐明Yu-[3+2+1]反应在合成具有桥头四级碳的天然产物和药物分子的巨大优势。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Protecting-Group-Free Syntheses of ent-Kaurane Diterpenoids: [3+2+1] Cycloaddition/Cycloalkenylation Approach
Jin Wang, Benke Hong, Dachao Hu, Yuichiro Kadonaga, Ruyao Tang, Xiaoguang Lei*
J. Am. Chem. Soc., 2020, 142, 2238-2243, DOI: 10.1021/jacs.9b13722
导师介绍
雷晓光
https://www.x-mol.com/groups/lei_xiaoguang
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
高氧化态对映-贝壳杉烯二萜的全合成:一类新型[5+2]串联反应的应用 2018-01-05
-
北京大学雷晓光课题组发现萜类天然产物合成中新的自由基化学 2019-05-15
-
连续C-H活化策略帮助实现复杂天然产物高效全合成 2015-09-24


































 京公网安备 11010802027423号
京公网安备 11010802027423号