Science:结构超复杂紫杉烷二萜的全合成
1963年,美国化学家M. C. Wani和M. E. Wall首次从美国西部大森林中被称作太平洋紫杉(Pacific Yew)的树皮和木材中提取出痕量的活性成分,发现其对离体的鼠肿瘤细胞表现出很强的抑制作用。由于其在植物中含量极低(每12千克干样中大约只能萃取出0.5克紫杉醇),直到1971年他们才同杜克大学的化学家A. T. Mcphail合作,通过X-射线分析确定了这种物质的结构——一种四环二萜化合物,并命名为紫杉醇(Taxol,1)。如今,“年逾花甲”的紫杉醇依然在治疗卵巢癌、乳腺癌、肺癌等多种恶性肿瘤中具有显著效果,根据统计,注射用紫杉醇2017年全球销售额仍高达约12.8亿美元。

紫杉。图片来源于网络
对于合成化学家来说,紫杉醇复杂而新奇的结构无疑具有巨大吸引力,据不完全统计全世界50多个顶尖团队先后投入到紫杉醇全合成的工作中,其中就有大家都知道的K. C. Nicolaou教授团队——1994年当时正在KCN课题组做博后的杨震教授等人完成了紫杉醇全合成(Nature, 1994, 367, 630-634)。到目前为止,化学家已分离出500多个紫杉烷类化合物,大致可分为11种骨架,其中2007年从加拿大紫杉中分离的(–)-canataxpropellane (2) 可能是结构最为复杂的紫杉烷之一:它在紫杉烷骨架的基础上额外增加了三个跨环C-C键,使得仅该分子骨架就拥有6个连续的季碳中心,高度氧化(5个羟基、1个酮羰基)且官能团化,这就决定了难以参考此前紫杉醇的全合成来设计该分子的合成路线。然而,这种奇特的结构也倒逼化学家必须从另一种视角去审视它:(1)这是唯一一个骨架中同时含有2个螺桨烷(propellane)单元的天然产物(下图C中的I ( [3.3.2]-propellane) and II ([4.4.2]-propellane));(2)它含有12个连续的手性中心(III),包括5个季碳中心,其中4个在环丁烷上(IV);(3)除了C6和C14,其骨架都由新戊基构成(IV)。
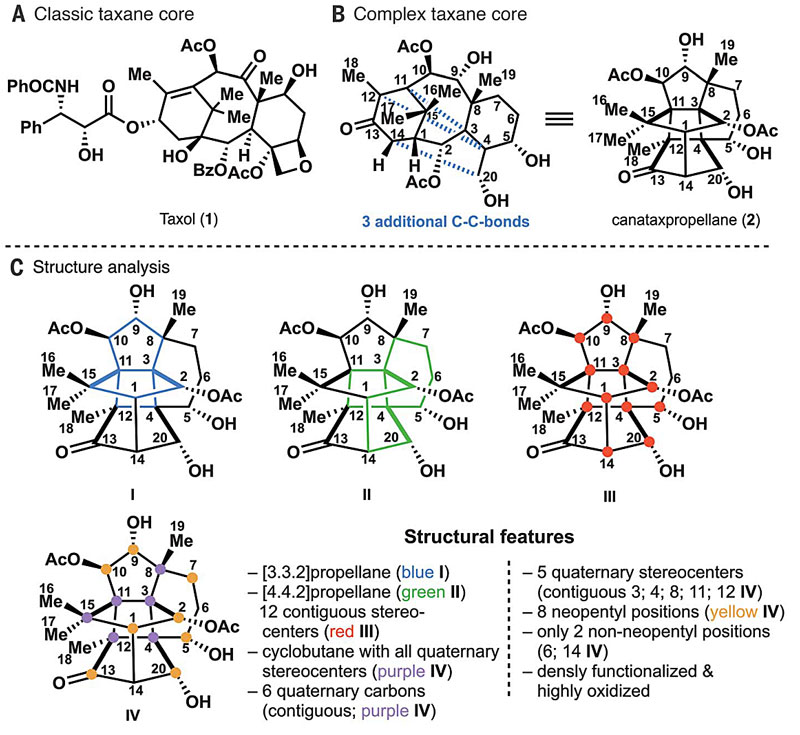
(–)-canataxpropellane的结构特征。图片来源:Science
正是上述视角打开了(–)-canataxpropellane的全合成之路。近日来自德国康斯坦茨大学的Tanja Gaich博士(P. S. Baran的学生)团队从一个已知中间体出发经26步(从商业化原料则是29步)以0.5%的总收率完成了该分子的全合成,相关结果发表在Science 上。如下图所示,他们认为A环可以通过二醛中间体3上C9和C10之间的pinacol偶联反应得到;而醛3中B环的官能团化需要将中间体4通过C8位引入季碳中心和C5位立体选择性羟基化实现;4中拥有四个季碳中心的环丁烷可通过中间体5的分子内烯烃-芳烃的光催化[2+2]环加成构筑,这也是迄今为止最具挑战的,不仅需要实现环丁烷的关环,同时要构建四个季碳立体中心(C3、C4、C11、C12);5则可通过中间体6和7的分子间[4+2]环加成制备。
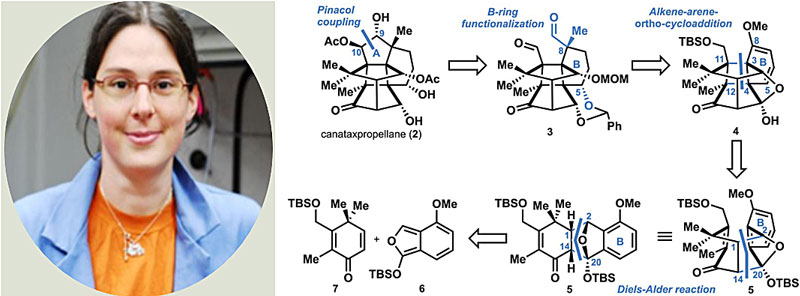
Tanja Gaich博士和逆合成分析。图片来源:Baran课题组网页和Science
首先,作者从合成消旋的canataxpropellane开始来试验这条路线的合理性。从已知的内酯8(以十克级规模三步法制备,总收率为90%)开始,经过去质子化和TBS-Cl捕获得到异苯并呋喃6,原位与亲双烯体7发生Diels–Alder反应得到5 (收率:71%;选择性:endo/exo = 100:1),优秀的endo选择性使得分子中环上的双键(C11-C12)和苯环(C3-C4)紧密靠近,有利于通过[2+2]光环化反应得到笼状中间体4(重复进行三次光反应,总收率73%)。接着,需要将4中的内半缩醛进行开环反应。但在尝试多种条件后,设想打开O–C20键上的桥头内半缩醛都失败了,而是在THF和TBAF的条件下,发生逆aldol反应断裂C14–C20键得到酮内酯9。经过分析,他们认为将9的酮羰基立体选择性地还原成羟基后,会自发与内酯发生转内酯化得到10,随后用甲氧基二氯甲烷(MOMC1)将C2-OH进行保护,通过三步得到11。接着通过LiAlH4将其还原、再经Swern氧化成二羰基化合物12后,在KOtBu作用下发生分子内aldol反应便可再次构筑C14-C20键得到单一的非对映异构体13。接着就是在B环上进行官能团化:在光作用下与氧气发生立体选择性的[4+2]光氧化反应,由于endo面(纸面下)位阻较大,所以氧气只能从exo面(纸面上)进攻得到单一的非对映异构体14。然而,想要切断endo-过氧键发生Kornblum–DeLaMare重排得到15却很有挑战性,不是原料分解就是产率很低,经过广泛的筛选,作者最后发现14经BHT还原以71%的收率得到15,但其C5位羟基的构象与canataxpropellane的正好相反,于是作者通过IBX选择性地氧化C5位羟基后再利用C20位羟基的邻基参与效应进行还原得到17。
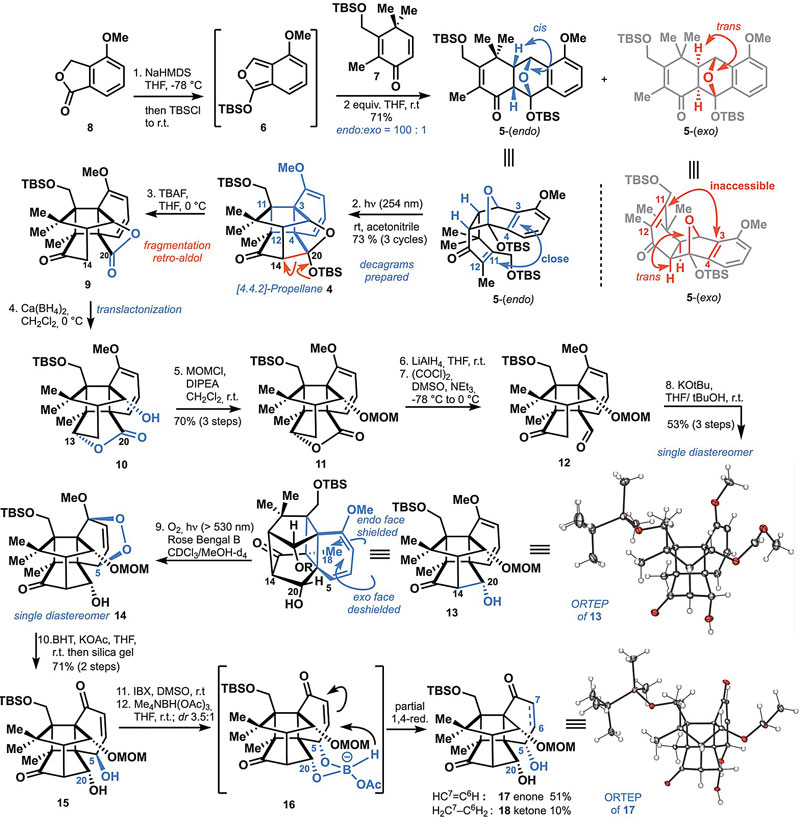
Canataxpropellane全合成,part 1。图片来源:Science
17经1,4-还原以95%的收率得到19,接着用Comin试剂(A)处理将C8上的酮转化为烯基三氟甲磺酸酯并通过钯催化的插羰反应以77%的收率得到α,β-不饱和酯20。20在Mg/MeOH中还原成饱和酯后进行α-烷基化得到21。21经LiAlH4还原、TBAF脱除TBS保护基得到二醇22,接着通过Swern氧化/pinacol偶联得到单一的trans-二醇23,单晶X-射线衍射显示其包含2的所有骨架特征和立体化学。接着将23上的C10和C9位上的羟基进行乙酰化保护,然后用BrB(catechol)脱除MOM基团,得到醇24,再经过选择性C9位去乙酰化(C10位乙酰酯位阻大)/选择性乙酰化(C2-OH活性更高)/去缩醛保护便可完成canataxpropellane(2)的全合成。
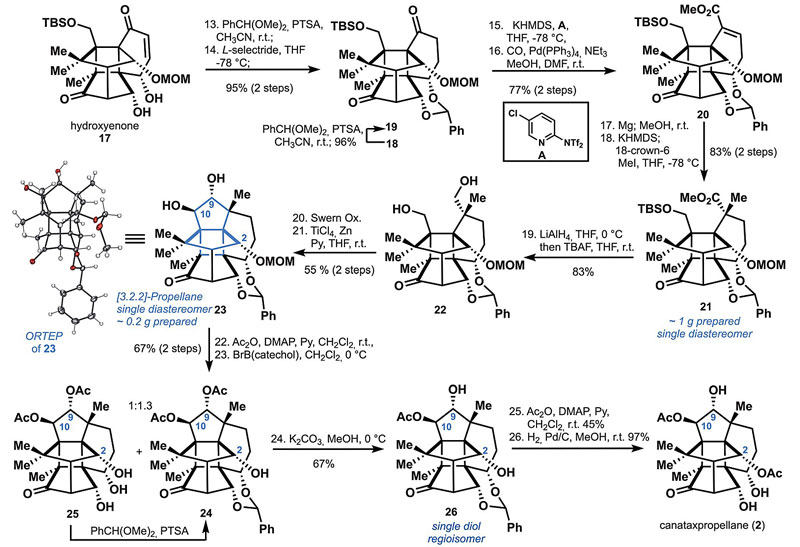
Canataxpropellane全合成,part 2。图片来源:Science
此时,很容易想到只要通过对映选择性的Diels–Alder反应制备光学纯的5便能完成(–)-canataxpropellane的全合成。尽管有大量文献报道手性Lewis或Brønsted酸催化的Diels–Alder反应,但应用到6和7时却出了问题,因为5对这些催化剂太敏感了,即使催化量也会分解。最后,作者只能想办法合成带有手性辅基的烯醇硅醚,希望利用辅基的手性实现不对称Diels–Alder反应。经过大量筛选手性氯硅烷,作者发现TADDOL(27)是最好的选择。将8和27转化为相应的烯醇硅醚后与7发生Diels–Alder反应顺利得到28(28:29 = 1.5:1),再经过上述相同的路线便完成了(–)-canataxpropellane的全合成。
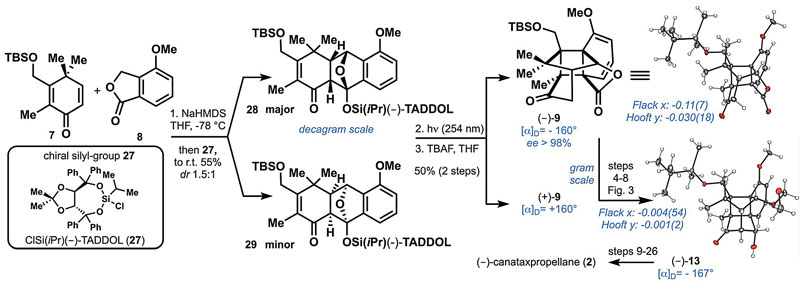
(–)-canataxpropellane的全合成。图片来源:Science
总结
全合成的魅力在于化学家从来不被束缚的想象力,只要足够合理就能创造无数条路线,而且在合成中还可以修正自己对化学的理解,甚至创造出优秀的方法学,完美地诠释了“方法总比问题多”的真理。以上(–)-canataxpropellane的合成便是精彩的案例,尽管总收率仅0.5%,但26步中18步可以十克级合成,还创造性地引入临时的手性辅基控制Diels–Alder反应的手性等等,都展现了作者对反应性和立体化学的深刻理解,值得大家学习和借鉴。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Total synthesis of the complex taxane diterpene canataxpropellane
Fabian Schneider, Konstantin Samarin, Simone Zanella, Tanja Gaich
Science, 2020, 367, 676-681, DOI: 10.1126/science.aay9173
(本文由峰千朵供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
天然产物paeoveitol的首次全合成 2016-10-19
-
天然产物Avenaol的全合成 2017-10-29
-
Stereoselective Synthesis and Antiproliferative Activities of Tetrafunctional Diterpene Steviol Derivatives.International Journal of Molecular Sciences (IF 4.9) Pub Date : 2023-01-06 ,DOI:10.3390/ijms24021121Dorottya Bai,Zsuzsanna Schelz,Dóra Erdős,Anna K Kis,Viktória Nagy,István Zupkó,György T Balogh,Zsolt Szakonyi

































 京公网安备 11010802027423号
京公网安备 11010802027423号