肿瘤耐药?“钙”我来了
肿瘤的多药耐药性是临床恶性肿瘤治疗失败、肿瘤复发的关键原因,也是困扰肿瘤治疗的一大难题。如何克服肿瘤耐药性,提高抗癌药物疗效已成为肿瘤治疗的世界性难题。近些年,生物学家和肿瘤学家已经对肿瘤耐药性发生发展的机制进行了深入探讨,提出了多药耐药基因及其编码的糖蛋白、多药耐药相关蛋白、DNA修复和复制酶等异常表达,钙离子浓度的改变等原因。
钙离子是细胞转导的第二信使,在细胞的多种生理过程如生长、发育、衰老、凋亡等过程中发挥重要的作用。目前,研究发现多种肿瘤细胞如乳腺癌、肺癌、胃肠癌等异常表达跨膜钙离子通道蛋白,使肿瘤细胞内钙离子异常活动,进而改变下游信号通路,在肿瘤的生长、抗凋亡、迁移及免疫逃逸中可能有重要作用。
在这一生物学机制的提示下,中国科学院北京纳米能源与系统研究所李琳琳研究员(点击查看介绍)团队与国家纳米科学中心梁兴杰研究员(点击查看介绍)团队合作,提出了一种全新的利用纳米药物克服肿瘤耐药的方法,采用二氧化硅纳米胶囊作为药物载体,共同递送抗癌药物阿霉素和T-型钙离子通道蛋白siRNA,实现了对耐药乳腺癌的高效治疗(图1)。
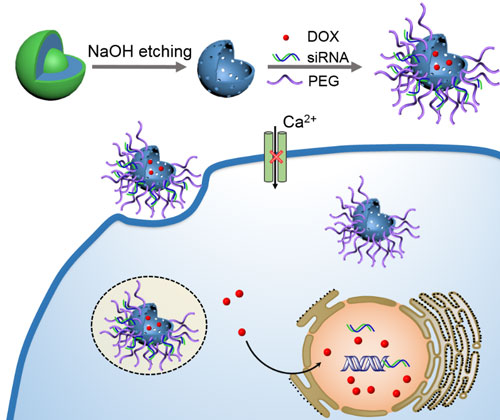
图1. 二氧化硅纳米胶囊共同装载阿霉素和钙离子通道蛋白siRNA治疗耐药乳腺癌示意图。
在该研究中,她们利用二氧化硅纳米胶囊的多孔特性和和大量的表面氨基,负载阿霉素和siRNA。结果发现,T型Ca2+通道siRNA的递送能有效降低乳腺癌细胞内静态Ca2+浓度,诱导耐药型乳腺癌细胞MCF-7/ADR细胞G0 /G1期阻滞,提高细胞内药物蓄积。这一阿霉素和siRNA共载系统对耐药乳腺癌表现出良好的协同治疗效果,和单独药物相比肿瘤抑制率提高超过46%(图2),为纳米药物的肿瘤递送提供了新的靶点和思路。
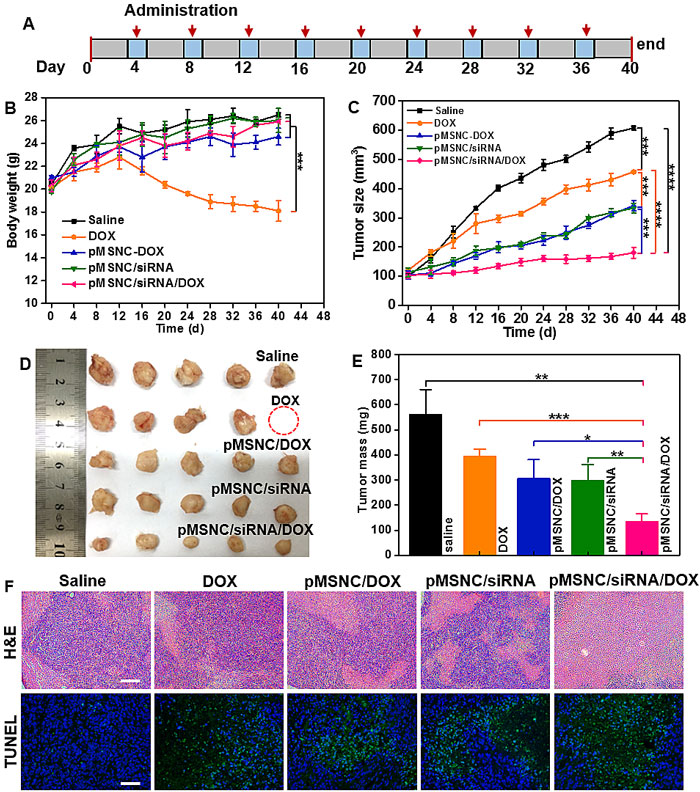
图2. 二氧化硅纳米胶囊共递送阿霉素/siRNA治疗MCF-7/ADR耐药乳腺癌肿瘤。
相关研究成果发表在ACS Nano 上,第一作者为中科院北京纳米能源与系统研究所的博士研究生王舒,李琳琳研究员和梁兴杰研究员为该论文的共同通讯作者。该研究工作得到了国家自然科学基金(81471784、31630027、31430031、31761133013)、北京市自然科学基金(2172058)和中科院青促会(2015023)等项目的资助。
该论文作者为:Shu Wang, Xi Liu, Shizhu Chen, Zhirong Liu, Xiaodi Zhang, Xing-Jie Liang, Linlin Li
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Regulation of Ca2+ Signaling for Drug-Resistant Breast Cancer Therapy with Mesoporous Silica Nanocapsule Encapsulated Doxorubicin/siRNA Cocktail
ACS Nano, 2018, DOI: 10.1021/acsnano.8b05639
李琳琳研究员简介
李琳琳,女,中国科学院北京纳米能源与系统研究所研究员,博士生导师,纳米能源与生物传感课题组组长,课题组一直致力于纳米生物材料及生物医学应用方面的研究。获2014年中科院卢嘉锡青年人才奖,2015年中科院青年促进会会员。主持国家自然科学基金,北京市自然科学基金等项目10余项。在JACS、Adv. Mater.、ACS Nano、Adv. Funct. Mater.、Small、Biomaterials 等期刊发表第一/通讯作者论文39篇,论文共被引用4000余次,H-index为28,参编英文专著3章。
梁兴杰
https://www.x-mol.com/university/faculty/23159
李琳琳
https://www.x-mol.com/university/faculty/23493
课题组主页
http://www.escience.cn/people/linlinnano/
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号