Nature Catalysis:人工酶也能玩转协同催化
发展更加可持续的方法是当前化学合成领域的趋势,其中,致力于实现绿色非天然反应的人工酶得到了越来越多的关注。人工酶区别于天然酶之处在于,它是一类具有非天然催化基团(过渡金属或有机催化基团)的蛋白质杂合体,其中非天然基团通过人工方法引入到蛋白质骨架。也正如此,人工酶相比于天然酶适用于更加广泛的反应类型。然而目前对人工酶的研究主要集中于引入单个非天然催化基团,因而反应速率、选择性以及反应类型较受限制。
最近,荷兰格罗宁根大学的Gerard Roelfes教授(通讯作者)和周志博士(第一作者)在Nature Catalysis 上发表文章,他们通过精心设计在蛋白质骨架中引入两个非天然催化位点,实现了首例在人工酶中进行的协同催化反应。此策略基于该课题组之前报道的两种人工酶设计方法:通过基因编码引入具有催化活性的非天然氨基酸(Nat. Chem., 2018, 10, 946)和通过超分子组装引入金属络合物(J. Am. Chem. Soc., 2015, 137, 9796)。得益于蛋白质内部空腔提供的手性环境和两个非天然催化基团的物理空间排布,研究者使用这种人工酶实现了一例高反应活性和高立体选择性的迈克尔加成反应。

周志博士(前排右一)、Gerard Roelfes教授(后排右三)
该人工酶的设计基于一种乳酸乳球菌多药耐药性调节因子(LmrR)。此蛋白是一个小型的同形二聚体,在二聚体界面上有一个异常大的疏水性空腔,空腔中心有两个相互平行色氨酸残基可以通过π堆积作用去结合外来平面分子(图1a)。之前Roelfes教授课题组已经运用LmrR蛋白的这种特性去结合非天然金属辅助因子例如菲咯啉铜Cu(1,10-phenanthroline)(NO3)2来构建人工金属酶并实现了吲哚对烯酮的不对称加成反应。其中,菲咯啉铜辅助因子作为路易斯酸来活化烯酮(图1b)。
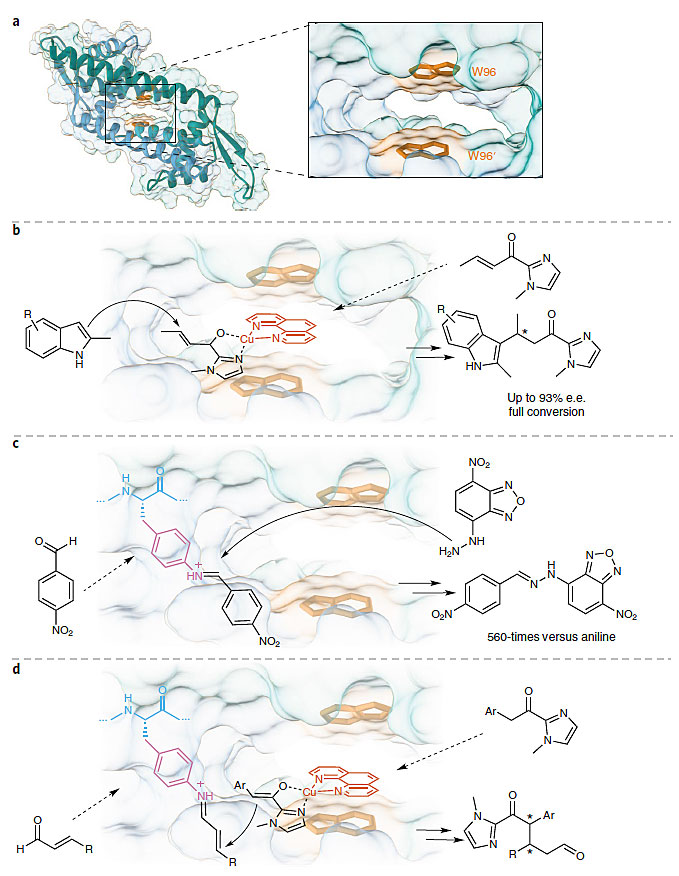
图1. 基于LmrR蛋白设计的人工酶。图片来源:Nat. Catal.
另一个策略是运用扩展遗传密码的方法即琥珀终止密码子抑制技术来引入具有催化活性基团的非天然氨基酸。近期Roelfes教授课题组应用这种方法构建了一个含有非天然的对氨基苯丙氨酸(pAF)残基的人工酶。在此人工酶中,对氨基苯丙氨酸的苯胺侧链被用作亲核性催化基团来促进醛转化成为腙。该反应机理涉及亚胺离子中间体的瞬时形成。这也是许多有机催化反应中常见的活化策略(图1c)。
基于之前的研究,研究者设想能否将这两种人工酶设计策略结合在一个蛋白质分子中,以创建具有两个可以同时作用的非天然催化位点的人工酶。在他们的设计中,α,β-不饱和醛可以通过与苯胺侧链形成亚胺离子中间体而被活化,而烯醇盐则通过路易斯酸Cu(ll)-phen络合物活化酮而形成,从而通过协同催化得到迈克尔加成产物(图1d)。亲核试剂结合的铜络合物将结合在两个平行的色氨酸残基之间,可以将烯醇盐递送至活化的烯酮的一个优选的前手性面,从而可以实现高的立体选择性。
在这项研究中使用的LmrR蛋白变体为LmrR_V15pAF,其疏水空腔内的15位含有一个非天然的pAF残基。pAF残基可以通过专用的正交翻译系统直接引入。然后路易斯酸位点通过向LmrR_V15pAF蛋白缓冲液中加入Cu(ll)-phen经超分子自组装结合。两者的解离常数(Kd)经检测为0.53 mM。为了测试这种新型人工酶的催化性能,研究者选用了一种反应活性非常低的咪唑酮(1a)作为迈克尔供体,但其可以在金属路易斯酸的作用下烯醇化。然后加成到丙烯醛(2a)上得到迈克尔加成产物(3a)。
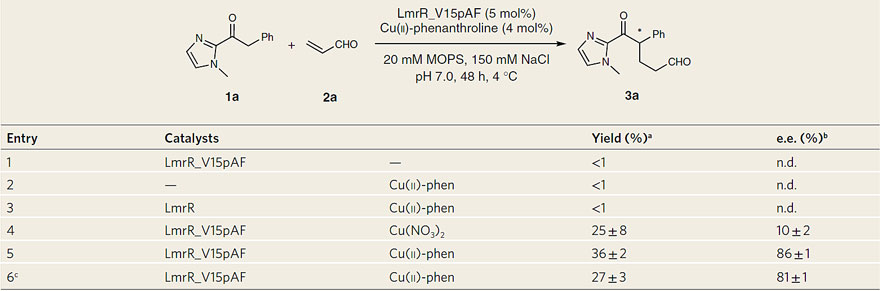
表1. 新型人工酶LmrR_V15pAF/Cu(ll)-phen协同催化的迈克尔加成反应。图片来源:Nat. Catal.
作为对照,研究者首先选用了经典的MacMillan仲胺催化剂来催化该模板反应,但反应的对映选择性和收率却非常差。另外,大部分常见的小分子胺催化剂与Cu(ll)-phen的协同催化体系也不能实现该反应。这些结果似乎说明这些胺催化剂与Cu(ll)-phen并不兼容。然而当研究者使用蛋白LmrR_V15pAF与Cu(ll)-phen的协同组合时,该模板反应能够得到36%的收率和 86%的ee。对照实验显示,仅有一个催化位点是不能实现该反应的。这也充分说明了该反应是通过协同催化的过程实现的。而且对照试验LmrR_V15pAF与Cu(NO3)2的结合仅能给出10%的ee,这也支持了研究者们的假设,即铜配合物与两个中心色氨酸残基的结合(这是通过菲咯啉配体介导的)对于反应的对映选择性十分重要。
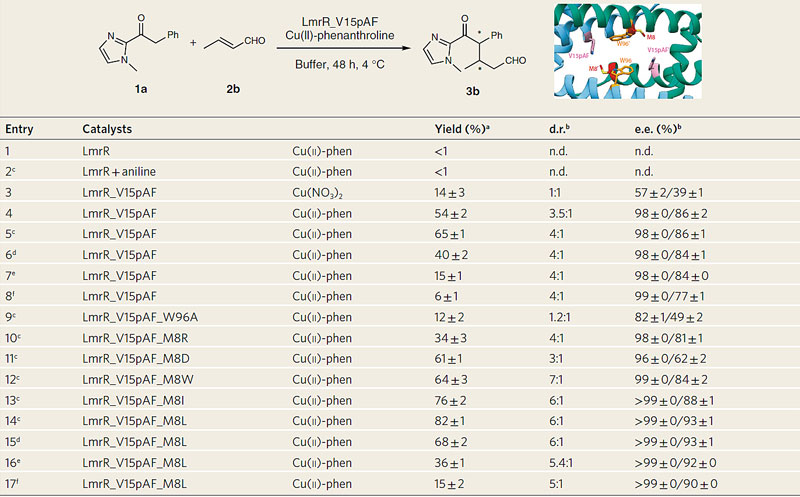
表2. 人工酶催化反应条件的优化与酶的突变研究。图片来源:Nat. Catal.
在这些实验结果的鼓励下,研究者用巴豆醛代替丙烯醛作为迈克尔受体进行了该反应,从而同时形成了两个手性中心。与巴豆醛的反应得到的两种非对映异构体均具有优良的对映选择性,其中ee分别为98%和86%。另外研究者也做了酶动力学实验,观察到饱和动力学,并将初始速率拟合为Michaelis–Menten方程,表观催化效率(kcat/KM(crotonaldehyde))为0.115±0.017 M-1s-1,表观kcat为 (2.58±0.38)×10-3s-1和KM(crotonaldehyde)为22.5±5.84 mM。研究者进行了有限的蛋白质突变实验,在之前的研究中他们发现,直接与蛋白空腔中心色氨酸相邻的8位蛋氨酸诱变在某些情况下有利于催化反应。最终他们筛选到突变体LmrR_V15pAF_M8L能够同时提升反应收率和立体选择性而得到>99/93% ee、6:1 dr和 82%的收率。而且催化剂用量即使降至0.5 mol%也不会影响反应的立体选择性。
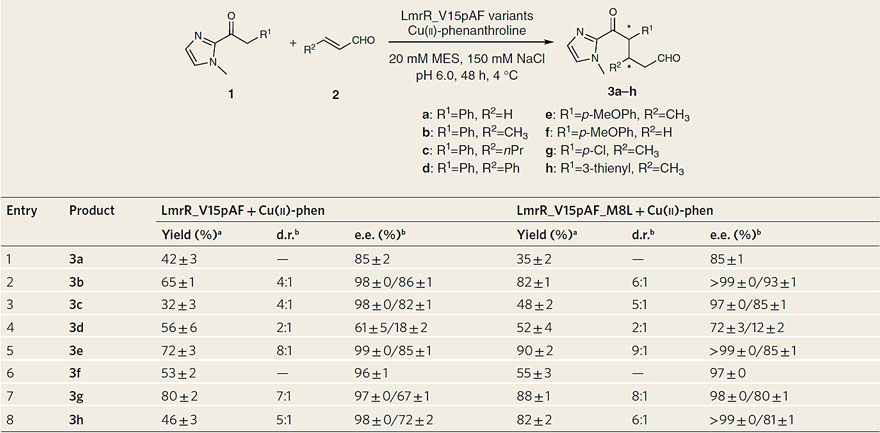
表3. 底物适用性范围研究。图片来源:Nat. Catal.
接下来,研究者也考察了该反应的底物适用性范围。实验结果表明此人工酶能够兼容一系列的不饱和醛和咪唑酮底物。除了芳香环取代的不饱和醛会导致反应对映选择性的降低外,其他烷基取代的不饱和醛和各种取代的咪唑酮底物均能得到非常优异的立体选择性。相比于LmrR_V15pAF,突变体LmrR_V15pAF_M8L能够给出相似或者更好的收率和对映选择性。另外研究者也通过捕捉关键反应中间体亚胺盐的形成从而证实了之前推测的协同反应机理。
总结
Gerard Roelfes课题组提出了一种新颖的人工酶设计方法,通过遗传编码非天然的具有催化活性的pAF残基以及利用超分子结合向LmrR蛋白二聚体界面疏水腔引入催化活性Cu配合物,实现了首例在人工酶中进行的协同催化反应。这种方法的功效在水相不对称迈克尔加成反应中得到了证明,表现出了出色的立体选择性和反应活性。另外,他们的人工酶设计具有高度灵活性,允许引入其他类型的有机催化非天然氨基酸,并可以结合其他金属配合物。这项研究为实现酶催化的非天然反应提供了一种有吸引力的方法。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Synergistic catalysis in an artificial enzyme by simultaneous action of two abiological catalytic sites
Zhi Zhou, Gerard Roelfes
Nat. Catal., 2020, DOI: 10.1038/s41929-019-0420-6
导师介绍
Roelfes group 主页
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号