Science:激发态电子转移实现光驱动的去外消旋化
去外消旋化广泛应用于药物分子、农用化学品以及精细化学品的生产过程。传统的去外消旋化方法有两种:通过手性配体或者手性催化剂将消旋的起始原料转化为手性产物;通过动力学拆分将外消旋体拆分为单一异构体(图1A)。然而,仍存在两个问题:在热力学上,将外消旋混合物转化为单一对映体是不利的,需要提供额外的能量来推动反应的进行。其次是动力学上的挑战,与微观可逆性原理有关。由于对映体的能量相同,沿着单个势能面将(S)转换为(R)的同时会伴随着从(R)到(S)的转换。因此,有效的去外消旋化既需要额外的能量来赋予反应的方向性,又需要不同的机制来建立和破坏立体化学的基本步骤。
Turner、Toste、周永贵等人的开创性研究表明,可以通过化学相容(或相分离)氧化剂和还原剂实现去外消旋化,其中氧化反应和还原反应是独立且平行进行的(Angew. Chem. Int. Ed., 2002, 41, 3177; J. Am. Chem. Soc., 2013, 135, 14090; J. Am. Chem. Soc., 2015, 137, 10496)。然而,这些方法仍存在一定的局限性。2018年,Bach等人报道了在光的催化下,使用手性光敏剂实现了联烯和环丙基喹诺酮的去外消旋化,该手性光敏剂对两个底物的对映异构体表现出不同的能量转移效率,从而得到较高对映选择性的单一异构体(图1C,Nature, 2018, 564, 240)。
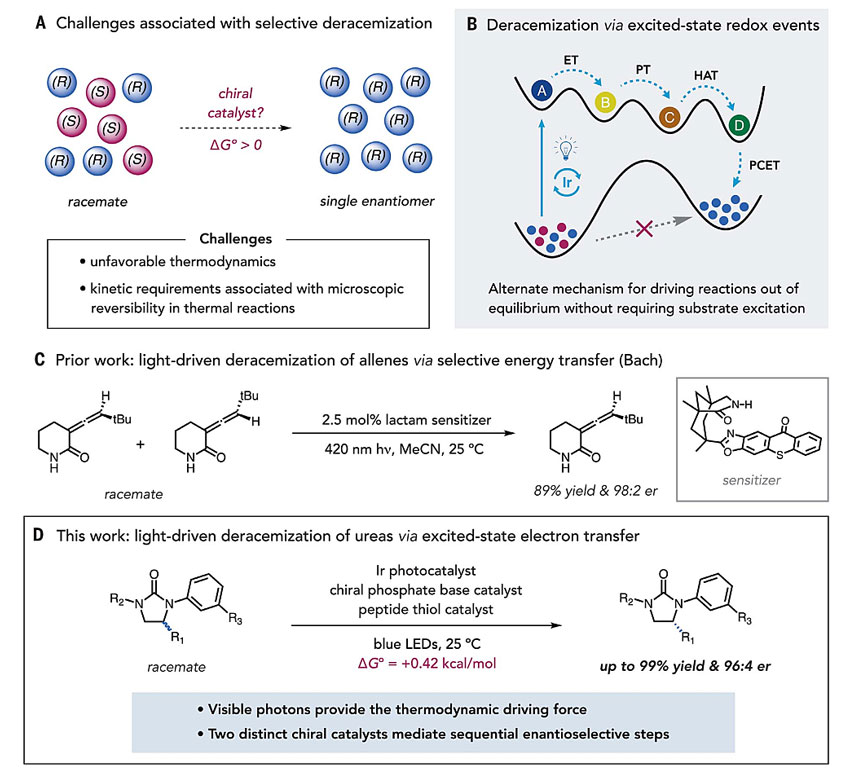
图1. 研究背景及本文工作。图片来源:Science
近日,普林斯顿大学的Robert R. Knowles教授课题组和耶鲁大学的Scott J. Miller教授课题组在此基础上,通过光驱动的激发态氧化还原过程实现了去外消旋化(图1B)。即由Ir(III)-光氧化还原催化剂、1,1’-联萘酚(BINOL)衍生的手性磷酸酯碱和含半胱氨酸肽硫醇氢原子供体组成的三元催化剂体系,在可见光的照射下,环脲化合物能够自发地得到高对映选择性的单一异构体(图1D)。该过程通过激发态的铱发色团引发反应,通过一系列有利的电子、质子以及氢原子转移步骤,实现C-H键的断裂和重建;其中对映选择性由两个独立的立体选择性步骤共同决定,相关成果发表在Science 上。
起初,作者试图进行先前报道的可见光照射下三元催化体系介导的不对称氢酰胺化反应(图2A)。当使用手性BINOL磷酸酯作为Brønsted碱时,能够实现去外消旋化,尽管对映选择性较差。然而,时间历程研究意外地发现,产物1b最初形成的是外消旋体,但在反应过程中却可以略微产生对映选择性。随后作者将消旋的1b在该条件下进行反应,得到了几乎完全转化的(S)-1b,这表明光驱动的去外消旋化途径是可行的,同样,对映体(S)-1b在相同的条件下,使用非手性磷酸酯碱可以实现消旋化。
在此基础上,作者假设Ir-光催化剂的激发态可逆地氧化外消旋脲底物,形成瞬态和对映选择性的芳烃自由基阳离子混合物(图2B),其中手性中心上的C-H键具有一定的酸性,可被磷酸酯碱夺去质子形成中性的α-氨基自由基。然而,由于自由基阳离子和Brønsted碱都是手性的,这一过程有助于动力学拆分对映体自由基,其中快速反应的(R)-对映体进行质子转移,而反应较慢的(S)-对映体与还原态的光催化剂Ir(II)通过电荷重组转化为起始原料脲。这种情况下,反应更利于生成(S)-对映异构体,质子转移后,得到的α-氨基自由基中间体可通过氢原子转移被非手性芳基硫醇共催化剂还原,从而以非选择性的方式得到脲。通过质子耦合电子转移(PCET)可使三种催化剂恢复其催化活性。
如果可行,该反应中产生和破坏立体化学的两个步骤(即质子转移和氢原子转移)是由两个独立的催化剂介导。因此,当质子转移和氢原子转移催化剂均为手性时,这两个基本步骤都有可能变成对映选择性,从而导致了一种不寻常的情况,立体选择性应该是对映体比的乘积(erobs= erPT•erHAT)。
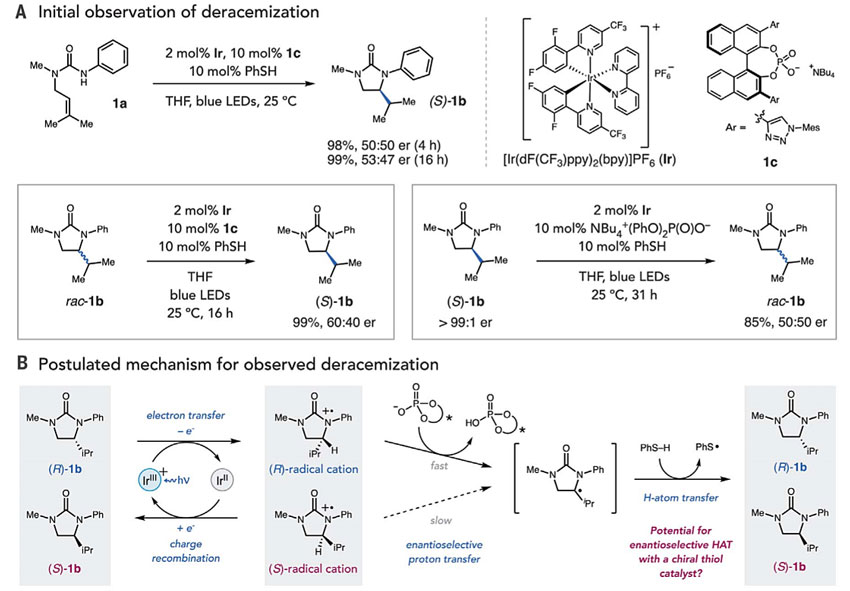
图2. 光驱动外消旋化的发现。图片来源:Science
为了验证这一假设,作者进一步研究了N-芳基取代环脲的去外消旋化(图3A)。首先,作者筛选了一系列BINOL衍生的磷酸酯碱,结果表明3e的效果较好,er值为79:21,当向反应体系中加入分子筛时,er值进一步提高到86:14。接着,作者筛选了一系列氢原子转移催化剂(半胱氨酸基寡肽),结果表明4e的效果较好,er值为78:22。在最优条件下,根据机理假设预测,由立体化学匹配的催化剂所介导的反应er值为96:4(即86:14*79:21 = 96:4)。事实上,rac-2a、3e、4e、Ir和分子筛在蓝光LEDs照射下进行反应时,2a的复合选择性er值为93:7。作者推测,可能是由于硫基介导的消旋过程导致er值有偏差,因此含有一个较弱的C–H键氢原子供体可能会优先与烷基硫基自由基反应并抑制外消旋过程。事实上,当向最佳条件中加入50 mol%三苯基甲烷时,er值可提高到预期值96∶4。进一步的研究表明,使用较低含量的催化剂也是有效的。控制实验表明反应中的任一组分都是必不可少的。
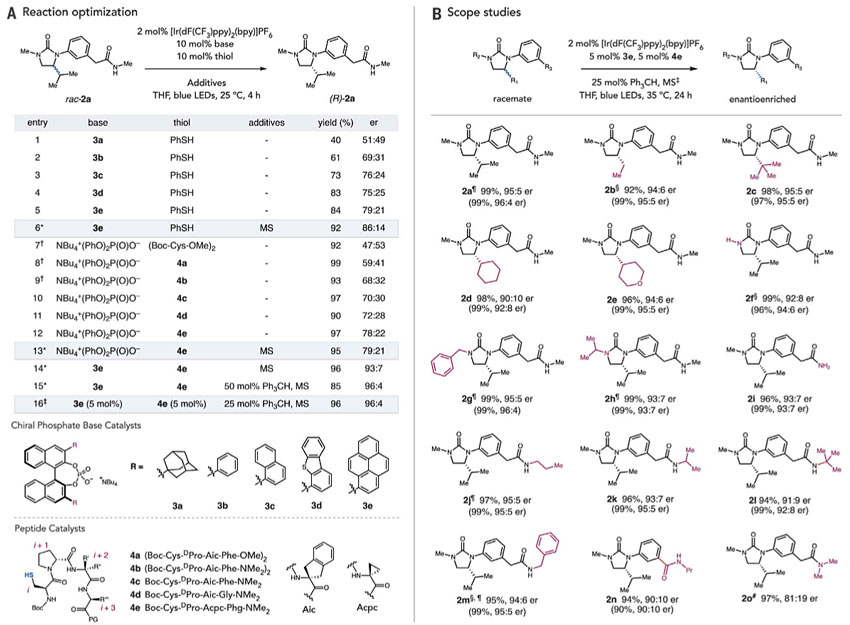
图3. 反应条件优化及底物扩展。图片来源:Science
在最优条件下,作者对反应底物的兼容性进行了考察(图3B)。手性碳上不同位阻的烷基取代基都可耐受,并具有良好的对映选择性(2a-2e)。游离酰胺、苄基或异丙基取代的远端脲上氮也以优秀的立体选择性得到去外消旋化产物(2f-2h)。链状酰胺上各种取代基也可以兼容该反应(2i-2n),而N,N-二甲酰胺类底物的er值则明显降低(2o)。当达到光学富集的稳态水平时,所有底物(2a-2o)都能以几乎定量的产率回收。
随后,作者进行了机理研究,稳态Stern-Volmer淬灭研究和时间相关的单光子计数实验表明,脲底物(EP/2 = 0.91V)与激发态Ir(*E1/2= 0.94 V)之间的电子转移在动力学上是快速的。随后的质子转移、氢原子转移和PCET步骤在热力学上也是有利的。这证实了由于从*Ir开始的所有基本步骤都是放热的,因此观测到的产物分布是由动力学控制的。稳定态er仅需1.5 h就可实现,延长反应时间后,产率和er值均未降低,表明该体系建立了稳定的非平衡状态(图4B)。此外,在优化条件下,催化剂控制的光学纯(S)-2a到(R)-2a的立体翻转具有优异的er值和收率(图4C)。
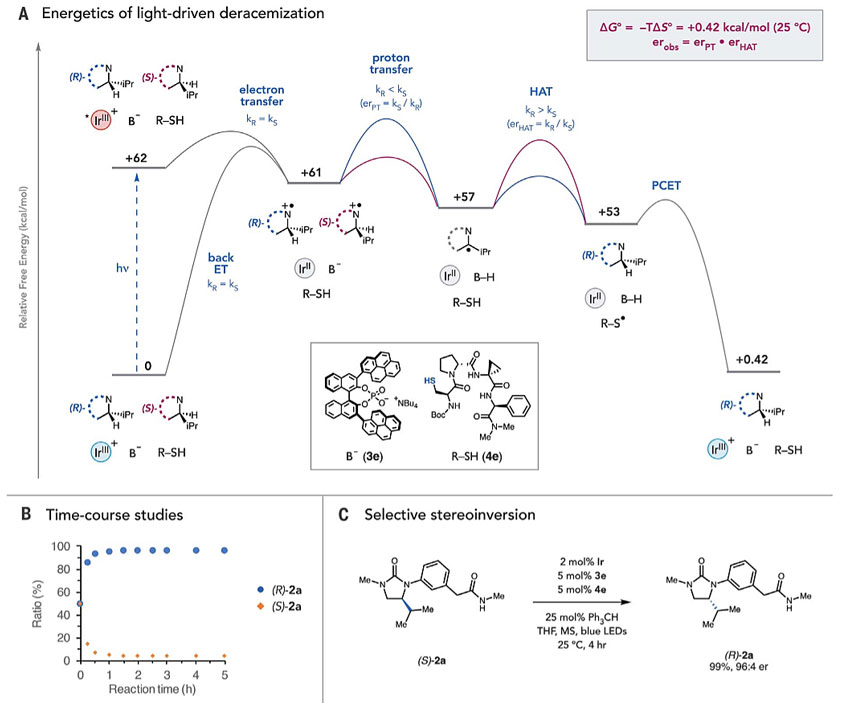
图4. 机理研究。图片来源:Science
为了研究两种手性催化剂协同立体选择性的适用性,作者分别探索了每种催化剂的对映选择性(图5)。首先,用手性碱3e和苯硫酚非手性氢原子转移催化剂对底物进行去外消旋化,结果显示其er值通常与含酰胺基侧链的底物一致,酰胺N-H键上的甲基化或去掉酰胺侧基均降低了er值,进一步证明了在不对称质子转移步骤中远端酰胺N–H键与磷酸根之间有潜在的相互作用。以半胱氨酸包埋肽4e和磷酸四丁铵二苯酯作为非手性Brønsted碱催化剂,对同一底物进行去外消旋化,为氢原子转移步骤的选择性提供了一种方法。虽然脲骨架上的取代基会带来较小的变化,但是对于所有底物而言,HAT步骤中的对映体选择性都是相似的。当使用两种手性催化剂的立体化学形式匹配时,所有情况下得到的er值与预测值非常吻合。相反,不匹配的硫醇ent-4e与碱3e的结合使得2a的er值减小,这表明了去质子化和HAT过程都倾向于(S)-对映体,进一步证实了两种手性催化剂在该转化中的协同作用。
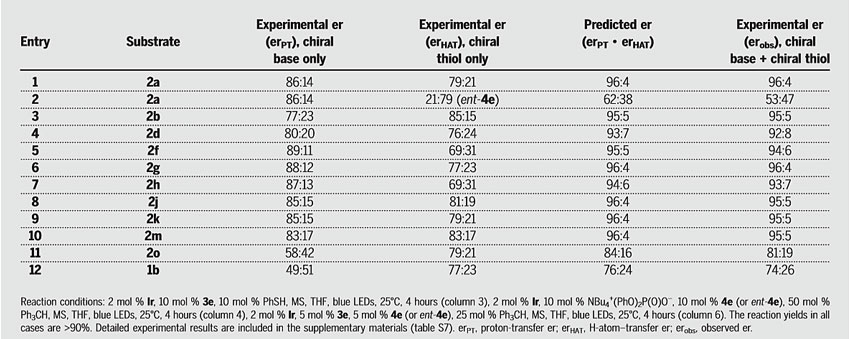
图5. 各种手性催化剂的协同对映选择性研究。图片来源:Science
总结
Robert R. Knowles教授和Scott J. Miller教授等人通过光驱动的激发态氧化还原过程实现了环脲类底物的去外消旋化,该反应底物适用性广,产物的对映选择性好。作者预计该反应也可以适用于其他光驱动的转化,以催化剂控制的方式实现去外消旋化。
MIT化学系的Alison E. Wendlandt教授在同期Science对该工作进行了题为“Photocatalytic deracemization fixes the mix”的点评 [1],他表示:“虽然报道的反应底物仅限于概念验证,但这样的情况无疑会变得更加普遍,特别是,目前的底物与重要的手性配体(例如噁唑啉酮)以及酶催化去外消旋化和立体翻转途径(例如,海因酶-脱羧酶系统)中的中间体结构相似,预示着有可能将这一方法扩展到氨基酸和其他重要手性分子的去外消旋化。”
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Light-driven deracemization enabled by excited-state electron transfer
Nick Y. Shin, Jonathan M. Ryss, Xin Zhang, Scott J. Miller, Robert R. Knowles
Science, 2019, 366, 364–369, DOI: 10.1126/science.aay2204
参考文献:
1. Photocatalytic deracemization fixes the mix
https://science.sciencemag.org/content/366/6463/304
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
铱催化四氢异喹啉的去外消旋化 2015-10-28
-
外消旋轴手性3-烯基吲哚酮类衍生物的高度区域、非对映和对映选择性去消旋化 2018-01-02
-
去对称化策略在铱催化不对称烯丙基去芳构化反应中的应用 2018-02-06




































 京公网安备 11010802027423号
京公网安备 11010802027423号