和Baran一起脑洞大开:从天然产物全合成到非经典阻转异构
结构决定性质,可以说是自然界中最普适的真理之一。例如,1894年Emil Fischer提出“锁钥模型”来探讨生物分子如何通过相互作用来执行生物学功能,他认为底物和酶类似“钥匙和锁”的关系,高活性且高特异性的酶只能催化那些具有特定结构、可以很好结合其催化位点的底物进行生化反应。从那时起,分子的三维形状便成为生物化学的关注重点。当然,现代生物化学理论——“诱导契合假说”更进一步地认为酶与底物分子在结构上存在相互适应和相互契合的过程。在该理论的指导下,现代药物研发更加注重化合物构象与靶点构象的柔性对接。长期以来,小分子的结构被认为仅由原子连接性和中心手性或轴手性定义。例如,类固醇激素都具有相同的基本碳原子骨架,它们不同的生物学作用取决于对该基本骨架外周的修饰。与小分子不同,像蛋白质这样的生物大分子要实现生物学功能,不仅仅需要具有正确的原子连接性(即一级结构),往往还需要在不断裂或形成新共价键的情况下折叠成具有生物活性的分子形状(即三级结构)。但是对于一些大分子来说,决定分子形状的主要因素是原子连接性而非构象变化。比如,DNA拓扑异构酶可以通过切割和重连磷酸二酯键来切换环状DNA的螺旋状态和解旋状态,这种现象称为拓扑异构(topoisomerism)。索烃(catenane)分子中也同样存在拓扑异构现象,在不断裂和重新形成化学键的情况下,拓扑异构体之间无法相互转化(图1左)。
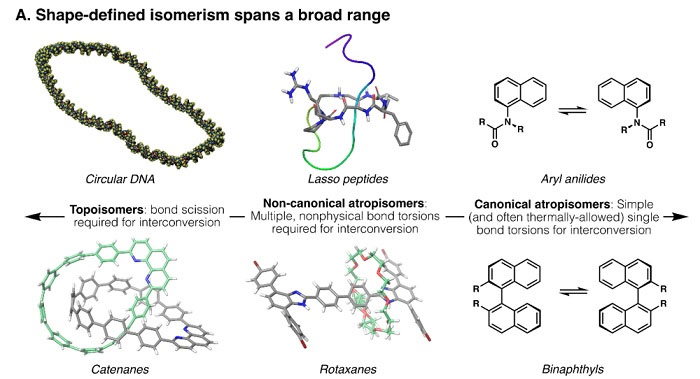
图1. 合成和天然分子中的异构现象。图片来源:Science
小分子中也存在着一种看起来有些相似的异构现象——阻转异构(atropisomerism),即由于键旋转受阻而产生的形状异构。经典的阻转异构现象,就是单键旋转受阻而产生的轴手性(如联芳基类化合物,图1右)。有经典,就有非经典。比如轮烷(rotaxane)和套索肽(lasso peptide)这些拓扑平庸(topologically trivial)的分子通过多个非物理键扭转可以形成不同于经典阻转异构的异构现象,这种现象称为非经典阻转异构(non-canonical atropisomerism)(图1中)。
天然产物小分子中也有非经典阻转异构现象。2017年,哈佛医学院T. P. Wyche等人提取分离出一种多环肽吲哚类生物碱Tryptorubin A(J. Am. Chem. Soc., 2017, 139, 12899-12902),当然,最初分离的时候研究者并未考虑该分子存在阻转异构,提出的分子结构(1)如图2所示。最近美国斯克里普斯研究所(The Scripps Research Institute, TSRI)的Phil S. Baran教授和哈佛医学院的Jon Clardy教授等人在进行Tryptorubin A的全合成研究过程中,发现其实际上存在两种非经典阻转异构体1a和1b(图2)。他们开发了一种合成策略,首次实现了非经典阻转异构体小分子的选择性合成。他们还研究了天然产物(1a)的生物合成途径,发现其涉及核糖体肽合成及随后的阻转选择性翻译后修饰。相关结果发表在近期Science 上。
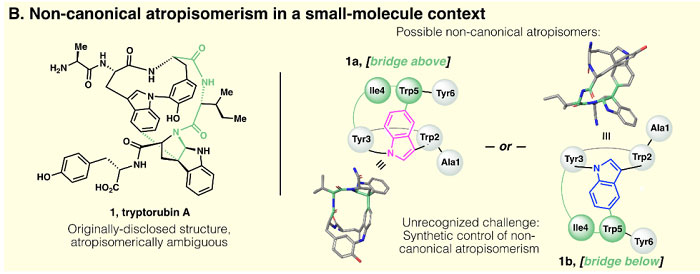
图2. 天然产物Tryptorubin A初始结构(1)和非经典阻转异构体(1a及1b)。图片来源:Science
事实上,作者刚开始全合成时只是想要征服这种结构复杂的天然产物,并未考虑到阻转异构现象。他们认为可以按照图3所示的策略进行Tryptorubin A的全合成。首先以数十克规模制备碘代物2,水解成羧酸以降低α-酸性,避免在后续构建C-N键时发生差向异构化,水解中间体再通过Ullmann-Goldberg-Buchwald-Ma反应构筑第一个大环得到吲哚3。本来预想溴代物4可以在Movassaghi发展的银盐介导的烷基化反应条件下直接与吲哚3进行反应构建C-C键,但实际操作过程中不仅收率低而且存在C5和C6区域异构体的复杂混合物。他们认为将吲哚3还原为吲哚啉5后可提高C5位的亲核性,从而抑制C6位异构体的出现。果然,用TFA/Et3SiH将吲哚3还原成吲哚啉5后,接着与溴代物4发生Movassaghi烷基化反应,随后被DDQ氧化,以中等的收率得到单一异构体吲哚6。接着在侧链上安装丙氨酸和异亮氨酸残基来延长肽链,随后去保护得到8。此时,想要从NMR上表征8是非常困难的(即使是高温核磁),因为存在酰胺键的cis/trans异构、多种可旋转的键以及后来推测的8a/8b之间的构象平衡等多种因素。有意思的是,中间体8的HPLC分析结果显示一个尖锐的单峰,并且高分辨质谱的结果也能对的上,这就给作者一种可以完成Tryptorubin A全合成的假象。最后,作者通过大量的实验以4%的总收率完成了第二个大环的构筑。不幸的是,化合物1b的氢谱、碳谱、HMBC、HSQC、ROESY和液相色谱(LC)的保留时间与天然产物1统统都对不上!
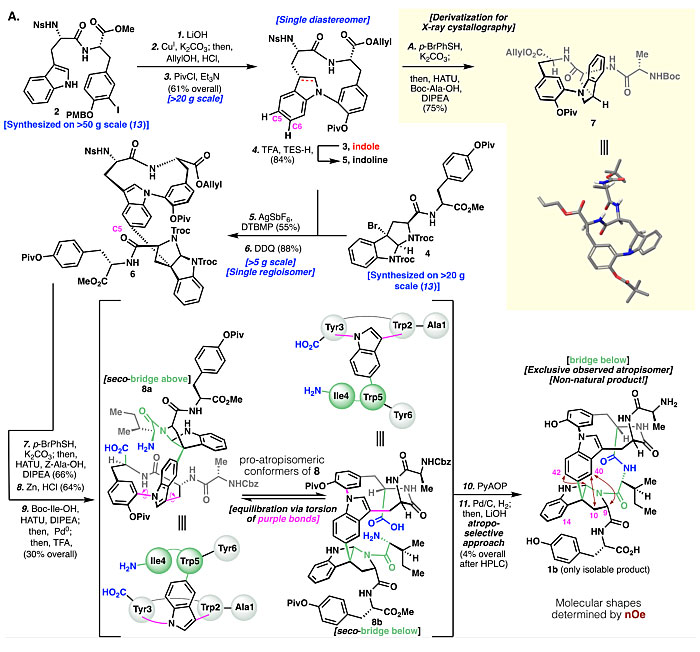
图3. 1b的全合成路线图。图片来源:Science
按照传统的思维,这时作者开始怀疑是不是天然产物1或者合成的化合物1b在立体化学(如D-型氨基酸)或者区域化学(如吲哚-吡咯吲哚啉上的C-C键)上出了问题?经过大量且仔细地对比1和1b以及C26位差向异构化体epi-8的各种光谱数据,他们确认天然产物1和1b竟然有着相同的连接性和中心手性!仔细分析两者的ROESY谱图后,他们发现1a上H9、H10与H42之间存在强的NOE效应(nuclear Overhauser effect)(图4),而1b上H9和H10则分别与H40之间存在相关(图3),这就表明虽然两个化合物的连接性和立体化学相同,但互为非经典阻转异构体——1a为“桥上(bridge above)”构象,1b为“桥下(bridge below)”构象。随后基于密度泛函理论计算预测的NMR也证实这一猜测,同时还表明1b相对1a具有更小的极性表面积,这也解释了为何在反相LC上1b的保留时间比1a长。
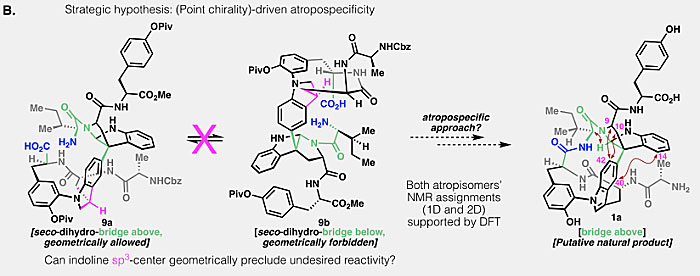
图4. 设想1a合成策略。图片来源:Science
另外,还有个问题需要解释:依照上述分析,中间体8也可能存在两种阻转异构体,理论上应该能得到1a和1b的混合物才对,但实际上为何只得到了1b?作者认为,这是因为在环化过程中8b是动力学上更有利的构象,因此才单一地转化为1b,即阻转选择性(atroposelectivity)。相反,如果能将环化前体锁定在“桥上”构象,那么就能合成1a。将这一假设与吲哚啉7的晶体结构数据相结合,作者认为在诸如吲哚啉9的底物中,吲哚啉的中心手性(图4中的紫色次甲基)会在结构上排除掉“桥下”构象异构体9b,从而接下来的9a环化就可以阻转选择性地得到“桥上”构象的阻转异构体1a。
在上述“中心手性驱动的阻转选择性”策略的指导下,作者以克级规模制备了含有丙氨酸侧链的吲哚啉10,然后与溴代物4通过Friedel-Crafts反应得到11,接着去保护并连接异亮氨酸侧链得到9,按照前文提到的“中心手性驱动的阻转选择性”原则,吲哚啉9应该是“桥上”构象。随后环化得到的产物12为单一异构体。然而,要想对吲哚啉12进行脱氢氧化却不太容易:在Pd/C条件下反应不能进行,原料回收;而在硝酸铈铵下底物则分解。最后,作者发现通过加入三氟乙酸将苯胺上的氮质子化以避免过度氧化,然后在DDQ作用下以及去保护可以顺利得到1a(图5A)。不过此时又出现了一段小插曲,1a的单晶、1a与蛋白质的共晶以及MicroED都没有拿到,这就没法直接证明1a等同于天然产物Tryptorubin A。只能依赖溶液NMR进行对比,尽管1a和Tryptorubin A的1H NMR谱图存在一定偏差,但这种偏差对于富含潜在氢键的天然产物是常见的,而且13C NMR和所有的2D NMR(HSQC、HMBC、ROESY)基本一致。另外,将1a和Tryptorubin A混合后用LC分析,发现保留时间完全一样,并且1H NMR谱图中只有一种物质。综合来看1a就是天然产物Tryptorubin A。
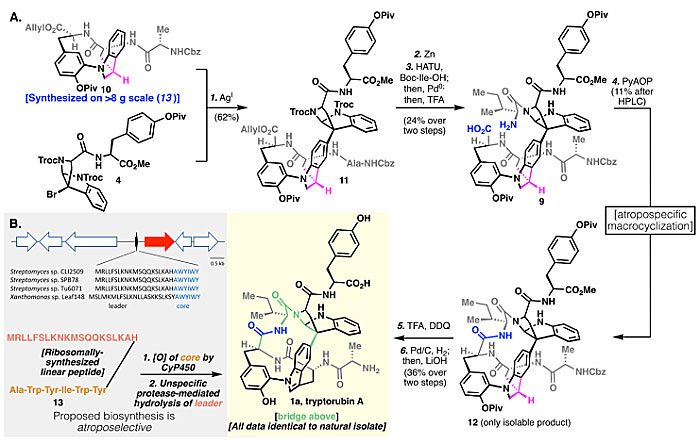
图5. 天然产物Tryptorubin A(1a)的合成路线。图片来源:Science
经历如此曲折的合成故事后,作者又进一步重新审视了Tryptorubin A的生物合成途径。他们认为之前提出的核糖体多肽合成酶参与的途径不能解释这种非经典阻转异构选择性的产生,因此他们又通过大量的生物学实验提出了新的理论,认为该过程涉及核糖体多肽合成和阻转选择性的翻译后修饰(图5B)。
1a和1b在升高温度时也不会相互转化,说明这两个非经典阻转异构体相互转化的能垒很高。从理论上讲,1a和1b这两个异构体相互转化需要分子进行非物理、由内而外的翻转,让一个大环穿过另一个大环(图6上)。这类似于轮烷的阻转异构反转,需要将套在哑铃结构上的环(图6中的绿色环)进行拉伸,使其能够越过哑铃结构的末端。在不断裂化学键的情况下,这种转化基本无法发生。这就与经典阻转异构体(联萘类化合物,图6下)形成了鲜明对比,后者可以通过简单键扭转而相互转化。
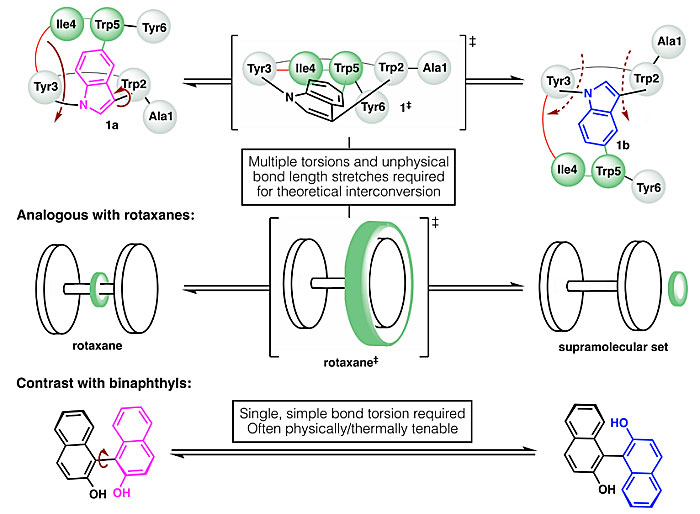
图6. 1a和1b相互转化的猜想。图片来源:Science
小结
不同于我们熟悉的经典阻转异构现象(如联萘类化合物),多环或机械联锁的分子中可能存在着非经典阻转异构。虽然也许在合成或者分离过程中某种异构体被不小心丢失,但化学家应当重新理解分子的三维结构,否则就不会诞生新的合成思想。Baran等人的工作不仅修正了Tryptorubin A的生物合成途径,他们提出的“中心手性驱动的阻转选择性”合成思想,也值得进一步深入学习。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Total synthesis reveals atypical atropisomerism in a smallmolecule natural product, tryptorubin A
Solomon H. Reisberg, Yang Gao, Allison S. Walker, Eric J. N. Helfrich, Jon Clardy, Phil S. Baran
Science, 2019, DOI: 10.1126/science.aay9981
导师介绍
Phil S. Baran
https://www.x-mol.com/university/faculty/668
(本文由峰千朵供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号