基于结构的药物设计:大环第四代EGFR抑制剂BI-4020的发现
在非小细胞肺癌(NSCLC)中,EGFR突变大约占12-47%,其中最为常见的两种突变是19号外显子的缺失突变(del19)和21号外显子的点突变(主要是L858R)。由此导致的表皮生长因子受体(EGFR)不依赖配体的异常活化会促进肿瘤细胞的增殖,这也是EGFR抑制剂开发的科学依据。临床上使用的一代(Gefitinib“易瑞沙®”、Erlotini“特罗凯®”,及icotinib“凯美纳®”)、二代(Afatinib“Gilotrif®”、Dacomitinib“VIZIMPRO®”及Neratinib“Nerlynx®”)及三代(奥西替尼,AZD9291)EGFR抑制剂对这两种突变的NSCLC肿瘤的客观应答率大约在60-85%。但这种应答并不能持续终身,通常在服药一代或二代EGFR抑制剂后第9.2到14.7个月时,患者会出现不同程度的耐药性。在这些耐药突变中约有50-70%发生在EGFR上门控位置(gatekeeper)T790M。该突变可引起EGFR空间构像改变,增加EGFR对ATP的亲和力从而削弱抑制剂与EGFR的结合能力。二代EGFR抑制剂Afatinib虽然在体外对EGFR-T790M突变有抑制活性,但在临床应用中仍然未能克服T790M突变产生的耐药性。且一代和二代EGFR抑制剂都很难排除对野生型EGFR的抑制,从而导致明显的皮肤毒性(如痤疮样皮疹)。直到第三代抑制剂奥西替尼的出现,这种情况才得以解决。
奥西替尼虽然解决了T790M突变的问题,但临床上已经观察到在奥西替尼二线治疗的EGFRT790M阳性NSCLC患者中,服药10个月后出现耐药现象,其中20-40%为C797S突变(即包含del19/T790M/C797S或L858R/T790M/C797S的顺式或反式三突变)。因此,开发下一代EGFR抑制剂则需要满足更多临床需求:一是对del19突变(最常见的突变形式)的EGFR具有高活性;二是能解决耐药突变T790M和/或C797S;三是对野生型EGFR无作用;四是在整个人类激酶组显示高选择性。

部分已上市EGFR抑制剂结构。图片来源:J. Med. Chem.
目前虽有文献报道了能克服T790M和C797S突变的EGFR抑制剂,但不是对野生型的EGFR选择性很差(如R1-R5),就是总的体外活性不高(R6)。其他诸如变构抑制剂的研究虽然能表现出对野生型EGFR很好的选择性,但主要是对含有L858R突变的敏感,而对最常见的突变del19却乏善可陈。
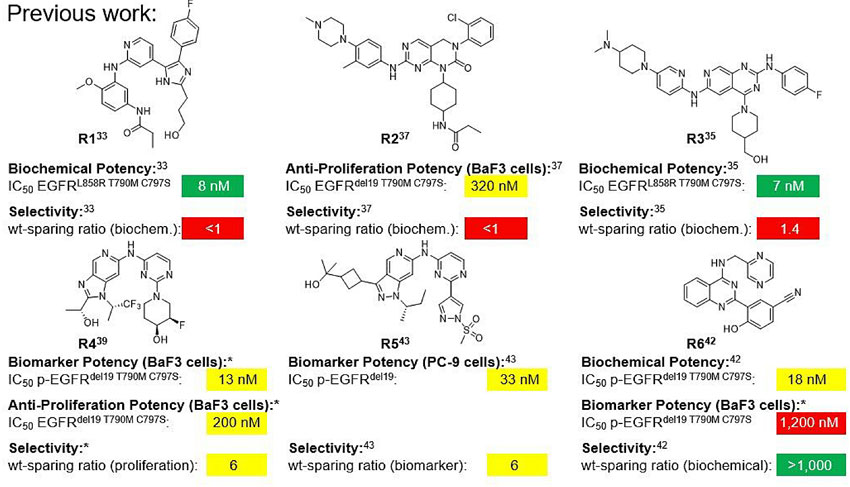
针对C797S突变的EGFR部分抑制剂。图片来源:J. Med. Chem.
最近,勃林格殷格翰(Boehringer Ingelheim)制药公司的科学家通过高通量筛选和基于结构的药物设计(Structure-based Drug Design, SDBB)在Journal of Medicinal Chemistry 上公布了首个第四代EGFR抑制剂BI-4020的发现过程。蛋白及细胞实验均显示其能有效抑制T790M和/或C797S突变的EGFR,并在含顺式三突变del19/T790M/C797S的小鼠异体移植NSCLC肿瘤模型(human PC-9)上显示很好的药效。
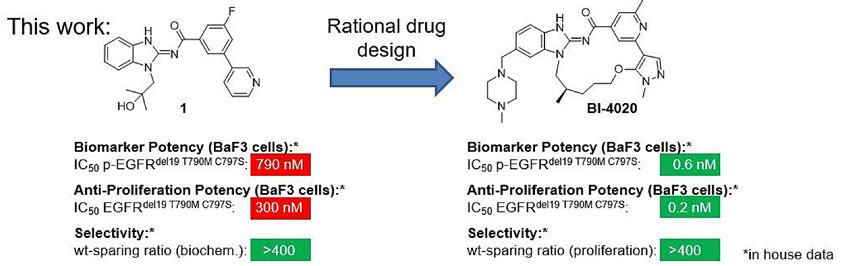
BI-4020的研发。图片来源:J. Med. Chem.
一、先导化合物发现
研究人员认为不同于一代EGFR抑制剂的设计路径,他们首先要解决的是对EGFRWT选择性的问题,因为提高活性相对来说更容易达到。首先,他们建立了一个来自激酶抑制剂和非激酶抑制剂项目的化合物库;然后用相对易得的三突变EGFRL858R/T790M/C979S和EGFRWT蛋白进行平行筛选实验,筛选其中对EGFRL858R/T790M/C979S具有较低IC50和对不超过10%的其他激酶有抑制的化合物。最终从中筛选到苗头化合物——氨基苯并咪唑类化合物1,对EGFRL858R T790M C979S的IC50为2100 nM,对EGFRdel19 T790M C979S的IC50为250 nM,对含有EGFRdel19 T790M C979S的BaF3细胞IC50为300 nM,并且未检测到对非突变EGFR(EGFRWT)的抑制,对一个包含238个激酶的文库中只有5%的激酶抑制率超过70%。
化合物1与EGFRL858R T790M的共晶显示,苯并咪唑环上N-H,羰基连接链与EGFR铰链区M793结合,异丁基羟基占据核糖口袋,吡啶上N与K745形成氢键并与相连苯环成约40°夹角,量子力学-扭转角扫描(QM-torsion angle scan)证实这是能量较低的构象,同时可以观察到整个分子并未与gatekeeper残基M790形成位阻效应,这也可以解释其具有选择性的原因。当去掉苯环F原子取代基后(化合物2),酶学和细胞活性并未受到影响,但后者在合成上更便捷,故后续优化不在R1位置进行取代。化合物1与EGFRL858R/T790M的共晶还提示如果将苯环上R2位置CH置换为N后,可能会与T854的羟基形成氢键,但此时联吡啶上两个N会形成偶极-偶极相互作用,导致能量上不利,通过量子力学-扭转角扫描也证实此时两个吡啶环呈30°左右的二面角,并非能量上最低的160°。体外实验发现化合物3的活性相对1有数倍提升(IC50 EGFRL858R T790M C797S =353 nM; IC50 EGFRdel19 T790M C797S = 57 nM),这与新增加的氢键弥补能量上损失有关。如果通过醚键连接两个芳基(如化合物3a或换成杂环如化合物4),虽然酶学和细胞活性可提高30倍,但化合物对其他激酶的选择性大打折扣。另外,研究人员认为化合物在低能量构象上表现出的差异可能会影响激酶抑制选择性。他们猜想抑制剂上两芳环能保持小于20°的二面角以及与T854结合可能会保持活性并提高选择性。为了验证这个设想,他们合成了化合物5,通过量子力学-扭转角扫描发现芳基二面角为20°和160°时能量基本无差别,共晶结构进一步证实此时两个芳环二面角为18°且吡啶N原子与T854形成氢键。酶学实验发现其对其他30个激酶无抑制,细胞抗增殖实验显示其对非EGFR依赖的细胞无抑制,表明其选择性非常高。
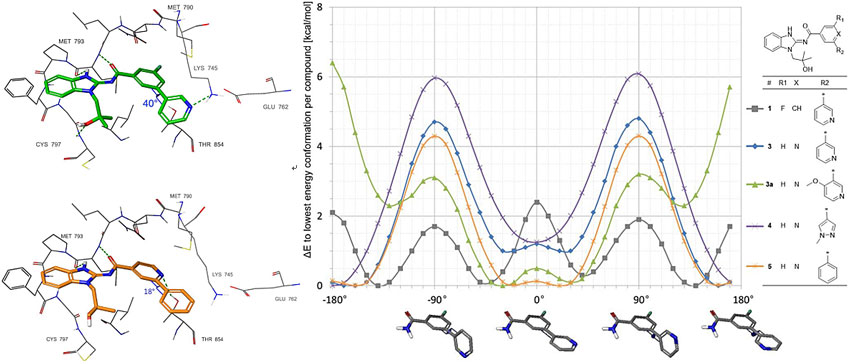
化合物1和5与EGFRL858RT790M的共晶及量子力学-扭转角扫描。图片来源:J. Med. Chem.
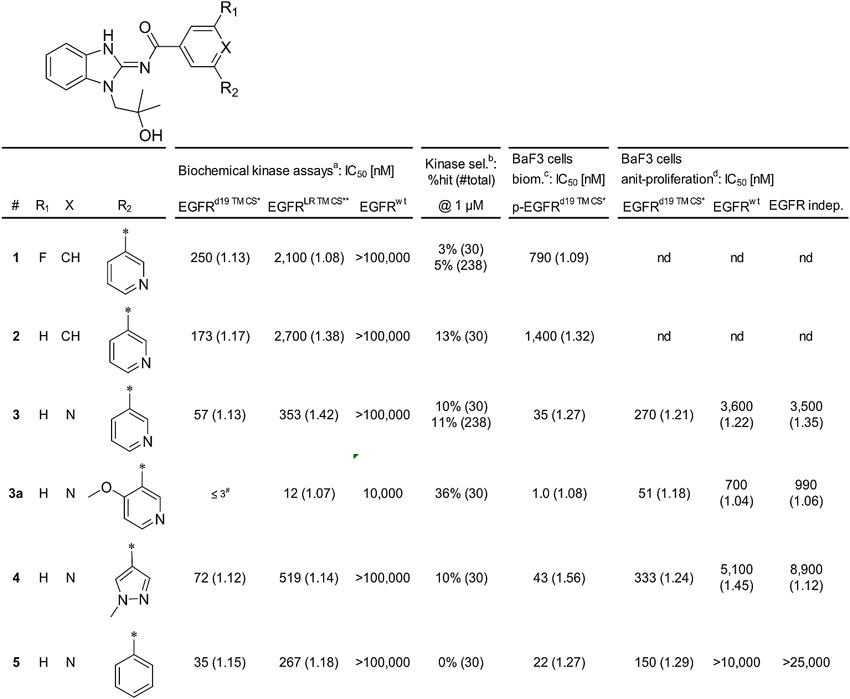
开链苯并咪唑结构化合物的构效关系。图片来源:J. Med. Chem.。
二、先导化合物优化
众所周知,细胞是生活在体液环境中的,药物分子发挥作用首先也要能一定程度溶解在体液中。这些溶解的分子只能采取某种特定构象与靶蛋白结合发挥生物学作用,可能的构象越多,熵的损失越大,最终表现为化合物活性的降低。就化合物1-5而言,这种开链结构必然存在很多构象,有的是“活性构象(active conformation)”而有的是“非活性构象(inactive conformation)”。根据QM-DFT计算模拟和蛋白共晶实验结果,化合物5的活性构象如下图所示,侧链羟基与联芳基的苯环在空间上靠近。受到劳拉替尼(lorlatinib)研发的启示,研究人员认为可以通过适当长度的连接链将两者连接起来形成大环以使分子固定在活性构象,有望提升活性。MOE模拟发现C5H10O作为连接链后能有效地使大环的构象与化合物5的活性构象重叠。化合物6与EGFRL85R T790M蛋白的共晶结构与计算模拟的构象一致,联芳环二面角成有利的40°,酶学及细胞活性相比化合物5则分别有17和5倍的提升,在1 μM下对所测的其他30种激酶没有抑制。
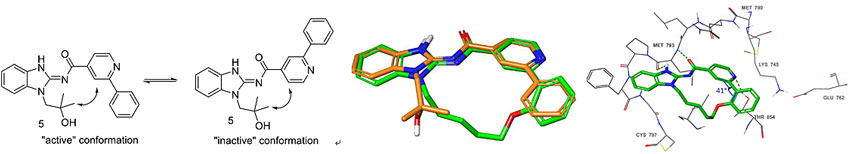
化合物6的计算构象及共晶结构。图片来源:J. Med. Chem.
细胞增殖抑制实验发现,化合物6对非EGFR依赖的细胞也有一定的杀伤作用,说明选择性不是太高。研究人员认为如果化合物能结合K745,也许能提高活性和选择性。于是,他们将苯环换成吡唑(因为之前发现化合物4的代谢稳定性比3高),合成的吡唑化合物7确实在酶学和细胞活性上都有所提高,但对非EGFR依赖的细胞增殖抑制活性也提高了,总的算来选择性并不比6好。鉴于之前研究发现芳环R1取代基对激酶抑制选择性比较敏感,当R1换成甲基取代后得到化合物8,其活性与化合物7相当,但对EGFRWT和非EGFR依赖的细胞增殖抑制活性明显降低,说明选择性增加。另外,这类大环化合物存在轴手性,若通过引入确定的手性中心来进一步控制分子构象,很可能会进一步增加活性。研究人员通过计算发现组装(R)-构象后形成其优势构象,因此化合物9对EGFRdel19 T790M C979S突变依赖的细胞IC50达到1 nM,且选择性得到提高。但9的水溶性不高且血浆蛋白结合力过高,因此下面需要优化药物代谢性质。通过之前化合物5和6与蛋白的共晶可以看出,苯并咪唑5位和6位暴露在溶剂区,这也是可引入增溶极性基团的位置。经过研究发现,5位引入极性基团后细胞活性会显著下降,而6位引入极性基团则能提高水溶性和细胞活性。经过几轮结构优化最终得到了化合物BI-4020,其溶解度为95μg/mL,渗透性Papp A-B为5.3x10-6 cm/s,均比奥西替尼高。
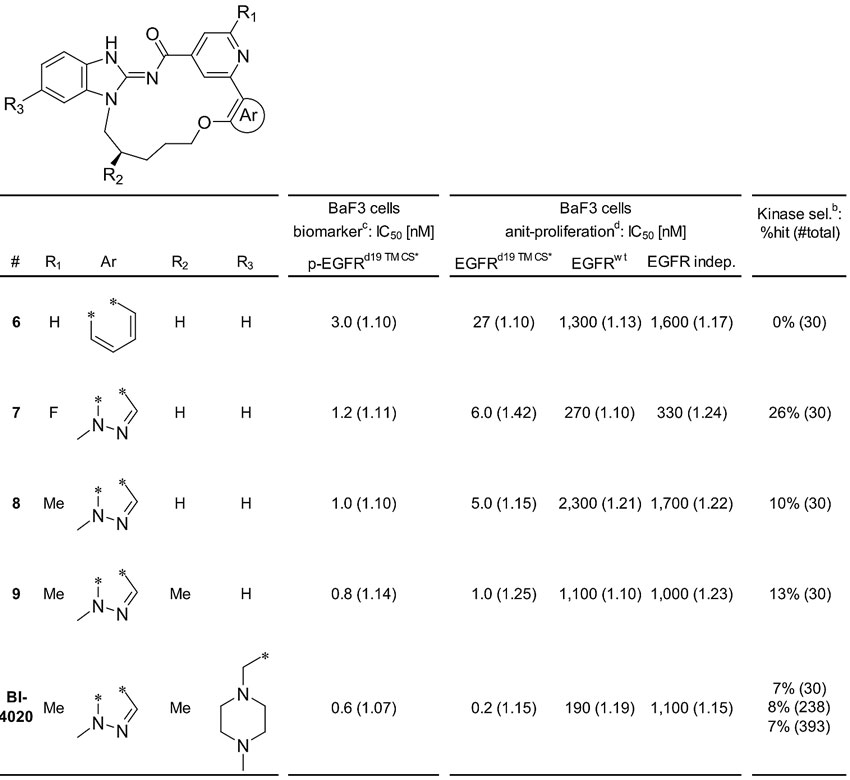
大环化合物构效关系。图片来源:J. Med. Chem.
在带有EGFRdel19 T790M C797S突变的PC-9小鼠异体移植肿瘤模型上,奥西替尼几乎失去了对肿瘤生长的抑制,而BI-4020则能使肿瘤消退(TGI=121%)
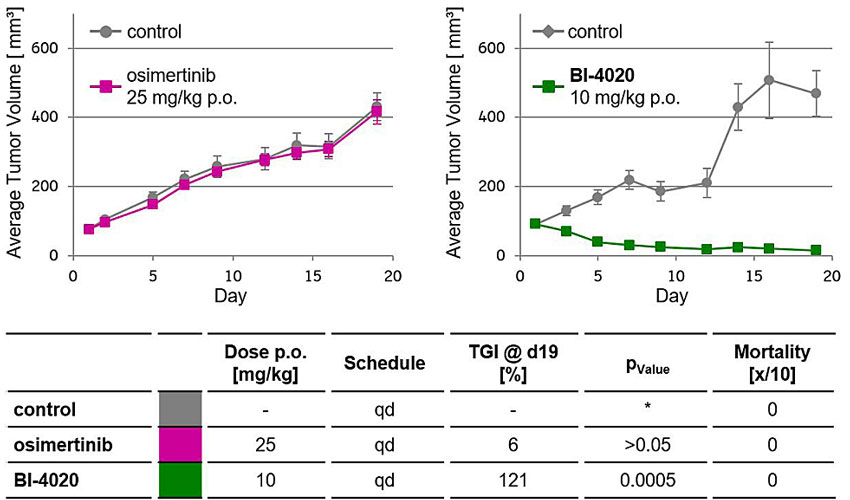
体内药效试验。图片来源:J. Med. Chem.
总结
药物发现已经从过去的随机筛选到理性设计,BI-4020的发现又一次证明了基于结构的药物设计策略在药物发现中的重要性。随着计算技术和人工智能的发展,也许终有一天人类能掌握足够的生物学信息,将参与生命活动的生物分子实现每个原子的数字化,动态地模拟每个时刻的状态,进而快速设计出药物分子改善人类健康状态。我们期待那一天早日到来,期待药物发现速度的再次提升,期待更多疗效精准的药物问世。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Start selective and rigidify: The discovery path towards a next generation of EGFR tyrosine kinase inhibitors
J. Med. Chem., 2019, 62, 10272-10293, DOI: 10.1021/acs.jmedchem.9b01169
(本文由冬宁供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号