核内“液-液相分离”对染色质结构的感知与重塑
本文获“BioArt”授权转载,版权归“BioArt”所有,任何转载需获得“BioArt”授权。
BioArt按

Cliff Brangwynne (Princeton & HHMI) 1: Liquid Phase Separation in Living Cells.图片引自:https://www.youtube.com
生物大分子的相变/相分离是近年来飞速发展的热门领域。自2009年德国马普所Tony Hyman教授与其博后Cliff Brangwynne发现线虫中的P.granules 实际上是蛋白质聚集形成的“液-液相分离”现象以后,科学家们逐渐发现细胞内的许多无膜细胞器——核仁、Cajal bodies、stress granules、miRISC,及突触的细胞骨架——都是特定的蛋白质/RNA的相变【1】。相变现象如此之普及,而促使液滴成核、生长的物理作用力为何,相变是否影响染色质结构,这些基本的问题尚未得到解决。

Cliff Brangwynne,2007年哈佛大学博士学位,2011年加入普林斯顿大学,现为化学与生物工程副教授,2018年入选为HHMI研究员。图片引自:https://www.princeton.edu/news/2018
2011年,Cliff Brangwynne在普林斯顿大学成立了自己的实验室,仍将研究重点集中于相分离现象及其机制上,并开发了一套能够在活细胞内发现、控制、调节“相分离”的方法。2017年,Brangwynne组在Cell上发表论文构建了一个光控的系统(OptoDroplets,下图)用于研究细胞内的相变过程【2】。
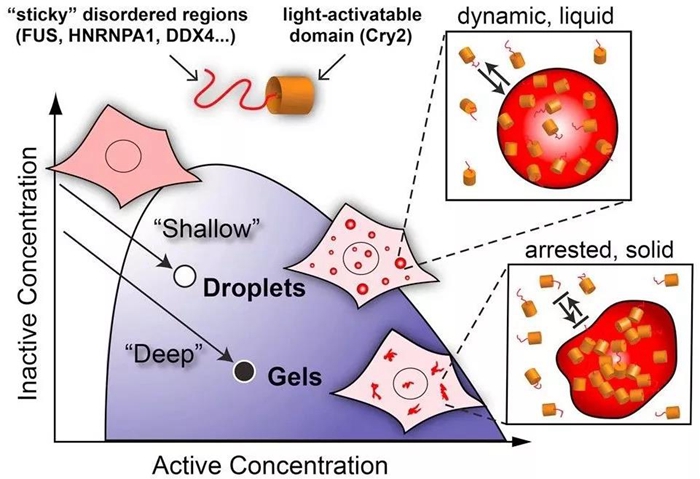
Light-Activated optoDroplets
在上述系统基础之上,Brangwynne组又设计了CasDrop系统(下图)。该体系由三个组分构成:SunTag标记的dCas9蛋白用于将体系锚定到特定的基因位点【3】;scFv标记的sfGFP和iLID融合蛋白用于构建光敏的多聚体;以及sspB标记的目的蛋白IDR(intrinsically disordered regions,IDRs)区域。在表达sgRNA的情况下,scFv-GFP-iLID蛋白被SunTag募集到SunTag-dCas9结合的基因位点处,由于一个SunTag可以结合24个scFv,故此处形成dCas9-ST-GFP-iLID蛋白的多聚体foci;在不表达sgRNA的情况下,dCas9-ST-GFP-iLID蛋白在胞内则成弥散状,在蓝光刺激下,sspB结合到iLID上,目的蛋白IDR相分离使得蛋白多聚,形成foci。该体系可以定量、定位地研究多种蛋白的相分离现象。
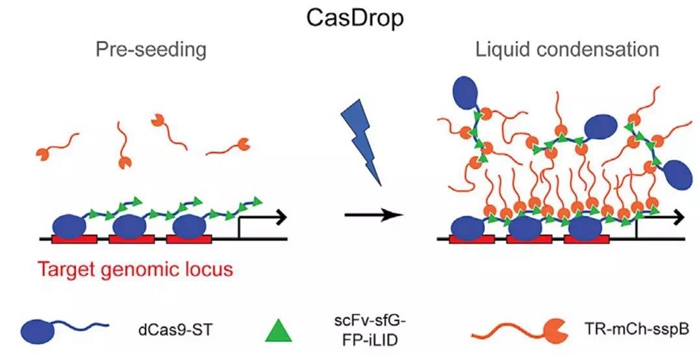
CasDrop系统
11月29日,Cell杂志在线发表了Cliff Brangwynne课题组利用CasDrop体系的最新研究成果Liquid Nuclear Condensates Mechanically Sense and Restructure the Genome(DOI:https://doi.org/10.1016/j.cell.2018.10.057)。该研究表明,细胞核内的“液-液相分离”现象能够感知并重塑染色质结构。

作者主要研究了FUS、BRD4、TAF15三个蛋白,三者均能在CasDrop体系的诱导下形成核内“液-液相分离”现象,且BRD4△N形成液滴的能力最强。在不表达sgRNA的情况下,作者发现BRD4△N更倾向于在染色质结构疏松处形成液滴。荧光共定位实验发现,液滴形成处的H2B-miRFP670的荧光强度有显著下降,提示相分离易发生在染色质密度较低的区域。随着液滴的增长,液滴所在区域的染色质会被进一步“推出”该区域,表现为H2B-miRFP670在相变处的荧光强度随时间延长而逐步下降。
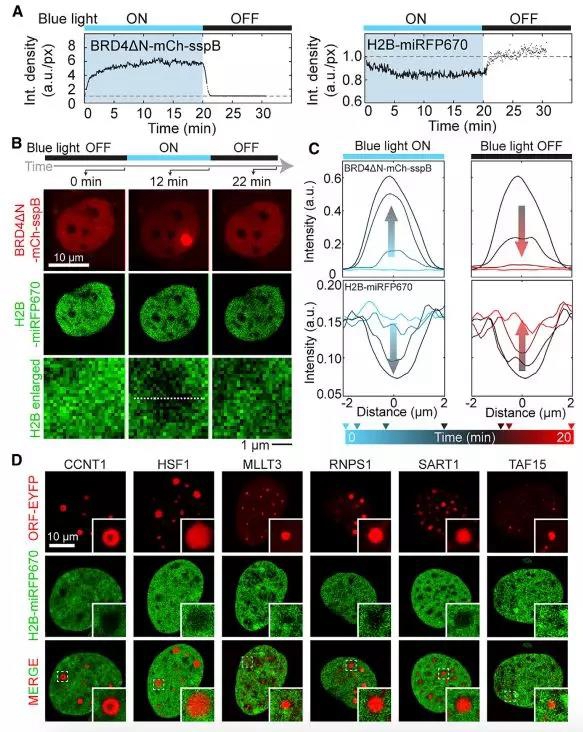
内源/合成的IDR所致相变均发生在染色质密度较低的区域,且随液滴增长,相变区域的染色质密度进一步降低
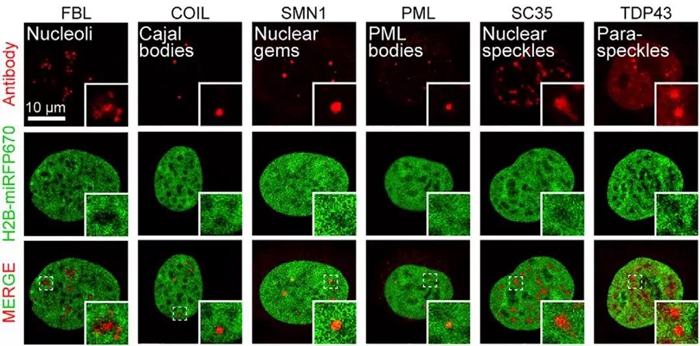
与此现象相符的是,细胞内核仁、Cajal body、PML body、亚细胞核(nuclear speckles)等无膜结构细胞器也倾向于在染色质密度较低处形成(下图)【4】。
随后,作者对相变形成的物理机制进行了详细探讨。作者以公式的形式描述了“液-液相分离”的液滴与可变形的染色质间的相互作用,液滴成核时的自由能损耗△F可通过下式描绘:
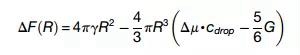
该公式说明较小的液滴在染色质密度高或低的区域均可以形成;而当液滴达到光学可分辨的大小时,则倾向于在机械上较软的区域(mechanically soft area)即染色质低密度区形成。
此外,该公式还推测:在染色质密度足够的区域,机械变形能将限制液滴的大小在一个临界值以下。作者利用CasDrop体系观察了BRD4在微卫星重复区、端粒和致密异染色质区的相变,发现BRD4在染色质低密度区域能够被诱导形成液滴,而在染色质高密度区,BRD4的液滴则仅在其周围形成液滴。计算模拟也得到了类似的结果——液滴在异染色质区域将形成花瓣样结构(下图)。当CasDrop体系将BRD4的液滴锚定在异染色质区域内HP1α密度相对较低的区域时,作者发现随着液滴的增大,HP1α被逐步剔除出该区域;而部分增大的BRD4液滴则可以扰乱异染色质的结构,最终使得该区域形成染色质密度下降。这些发现表明在相变发生的过程中,其周围的染色质提供了一定的机械阻力。
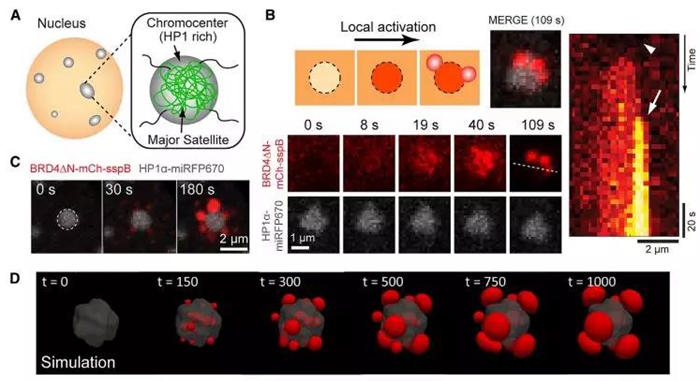
BRD4“液-液相分离”的液滴与HP1α富集的异染色质互不相溶,形成花瓣样结构
考虑到先前研究表明,超级增强子和其他核蛋白的相变能够将特定基因区域的距离拉近【5, 6】,作者对集中于端粒的“液-液相分离”液滴进行了进一步研究:端粒区的相变如花瓣样集中于异染色质的周围,液滴与异染色质间相互粘附;当两个液滴相互融合时,其各自所粘附的异染色质区域则靠拢在一起。
本文所证实的核内相变液滴排斥染色质的倾向有其物理学意义:“液-液相分离”液滴对染色质的排斥会导致染色质结构的重塑。这一过程则需要应变能——即染色质内部储存的机械能的释放——而这一过程从热力学角度来讲是不经济的。因此,染色质本身的性质会影响相变液滴的形成——即相变易发生在染色质结构较为疏松、应变能较低的区域;染色质致密区域的较小的相变液滴则最终倾向于溶解。“液-液相分离”的这一性质被总结为染色质过滤模型(“Chromatin Filter” model)(下图),即结合在特定基因位点的蛋白质的相变能够将距离较远的基因拉近,且排斥不含结合位点的背景基因区域。这保证了超级转录因子在染色质结构疏松的区域的聚积、对染色质的折叠、和促进活跃基因的表达(Science亮点丨超级增强子通过相分离调控基因表达)。
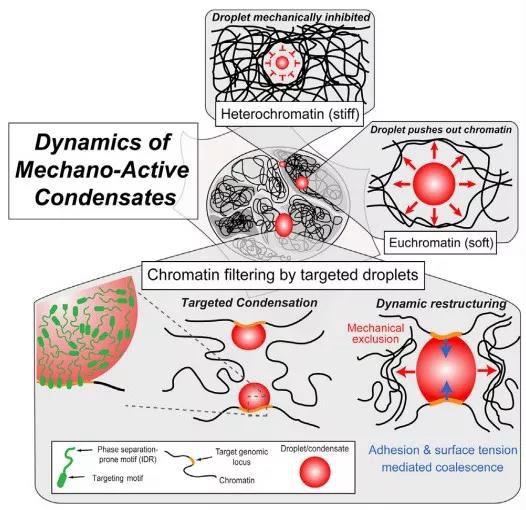
Chromatin Filter Model
参考文献
1. Boeynaems, S., et al., Protein Phase Separation: A New Phase in Cell Biology.Trends Cell Biol, 2018. 28(6): p. 420-435.
2. Shin, Y., et al., Spatiotemporal Control of Intracellular Phase Transitions Using Light-Activated optoDroplets.Cell, 2017. 168(1-2): p. 159-171.e14.
3. Tanenbaum, M.E., et al., A protein-tagging system for signal amplification in gene expression and fluorescence imaging. Cell, 2014. 159(3): p. 635-46.
4. Yuntao S. Mao, B.Z., David L. Spector, Biogenesis and function of nuclear bodies.Trends in Genetics, 2011. 27(8): p. 295-306.
5. Sabari, B.R., et al., Coactivator condensation at super-enhancers links phase separation and gene control.Science, 2018. 361(6400).
6. Boija, A., et al., Transcription Factors Activate Genes through the Phase-Separation Capacity of Their Activation Domains.Cell, 2018. 175(1-14).

如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!





















































 京公网安备 11010802027423号
京公网安备 11010802027423号