超分子笼化身“快递小哥”,细胞里也能“送货上门”
了解药物传递系统如何成功地靶向细胞内细胞器(subcellular compartment),在生物纳米技术、细胞生物学和纳米治疗等许多领域具有重大意义。虽然各种纳米颗粒(NPs)、穿膜肽(CPPs)、碳纳米管(CNTs)甚至金属有机框架(MOFs)都被用做“货物载体”,把外界生物活性物质运输到细胞内,然而细胞内运输与这些系统结构性能的基本关系,迄今却很少讨论。由于尺寸较小(1-10纳米)和官能团修饰方便,多孔配位笼(porous coordination cages, PCCs)这种超分子笼作为“货物载体”在癌症纳米治疗和阐明有关细胞器靶向的基本信息方面具有很大的潜力。不过,科研工作者目前对超分子笼主要从主客体化学和催化角度对其进行研究。由于长期以来化学稳定性差、缺乏生物相容性和生物毒性的研究,超分子笼用于生物医药方面的应用鲜有报道。
最近,美国德州农工大学(Texas A&M University)化学学院的周宏才教授(点击查看介绍)课题组联合该校生物化学和生物物理学院的Jean-Phillippe Pellois教授(点击查看介绍)课题组,报道了三种具有不同电荷的多孔配位笼,包裹药物,实现细胞内不同细胞器的靶向释放,达到调控抗癌活性的结果。第一作者为方煜博士,并且得到了德州农工大学生物系Beiyan Nan博士和中科院化学所黄嫣嫣博士的大力支持。
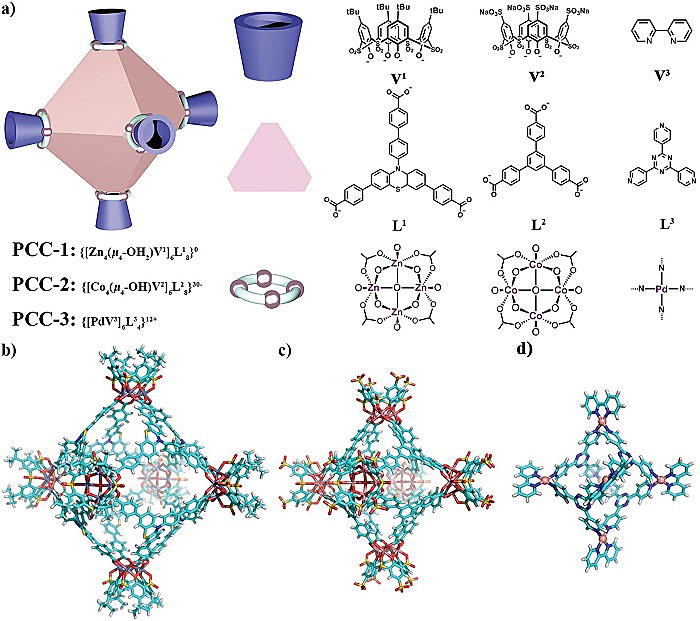
图1. 三种多孔配位笼设计和晶体结构。图片来源:Small
作者首先筛选了几种超分子笼。他们选择了已报道超分子笼结构中最为普遍的拓扑结构之一的八面体(图1)。根据这个拓扑结构,他们合成了一种自带荧光的PCC-1,以及之前报道过的PCC-2和PCC-3。这种三种超分子笼都是正八面体笼状结构,外径尺寸分别为5.0纳米、4.2纳米和2.8纳米。PCC-1和PCC-2是由三齿羧酸配体和杯芳烃与过渡金属(锌和钴)组装而成,唯一不同是PCC-1为中性分子,而PCC-2是一个带30个负电荷的阴离子分子。PCC-3是选择了Fujita的正八面体笼,由三齿吡啶和二齿联吡啶与钯螯合而成,它的特点是带有12个正电荷(图1a)。通过X-射线单晶衍射,它们的晶体都能被清晰的解析出来(图1b-d)。能够精确知道分子组成和源自级别的调控,也是晶态材料的一大优势。作者认为,通过对结构的精确调控,得到相应的“生物-纳米”界面信息和作用力信息,能够更好地认知“结构-性能”之间的关系。
由于分子笼都有空腔,这些空腔往往被用来包裹不同的客体分子。于是,作者接着研究了三种分子笼对染料和药物分子的包裹(图2)。由于PCC-1本身带有荧光,不需要引入其他分子就可以研究其细胞内的传递路径。作者用PCC-1包裹了一个抗癌药——喜树碱(Camptothecin, CPT)。喜树碱是DNA拓扑异构酶抑制剂,作用机理是当细胞DNA复制时,阻止异构酶从DNA单链上解离下来,从而导致细胞凋亡。而PCC-2和PCC-3本身不带荧光属性,它们分别包裹了正电荷染料罗丹明B(Rhodamine B, RB)和中性疏水性染料尼罗红(Nile red, NR),从而方便细胞内追踪(图2g)。作者使用紫外-可见光谱和荧光光谱表征了包裹客体分子后的超分子笼(图2e-f)。随后,这些包裹了客体分子的超分子笼被放到用来模拟细胞内环境的PBS缓冲溶液里,研究客体释放的速度。从图2h可以看到,这些超分子笼均能够在pH值7.4附近(模拟细胞质环境)短时间内保持稳定(2-8小时),客体分子不被放出来。但随着时间的延长,超分子笼最终会释放大部分的客体。如果pH值降低到6.5左右(模拟内囊体和溶酶体的环境),这些超分子笼释放客体分子的速度加快。作者认为,客体释放是由于超分子笼的逐渐解离造成的,毕竟这些配位键是半稳定状态的共价键。对于客体释放时间的延迟,作者认为这有利于高通透性和滞留效应(EPR),这也是大多数纳米材料载体的特性。只要在特定时间内把客体分子传递到相应靶向位点,之后载体即使分解也不影响,反而更容易排除体外。
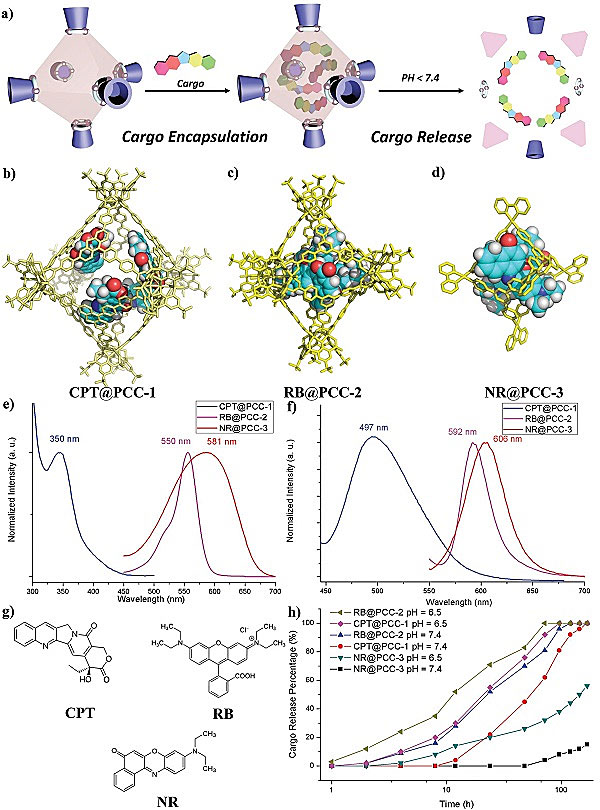
图2. 药物包裹与释放。图片来源:Small
接下来,作者使用了共聚焦显微镜(CLSM)和荧光显微镜(Epi-fluorescence Microscopy),对这些超分子笼的细胞定位进行了研究(图3)。作者首先通过共聚焦显微镜对比了客体分子本身与超分子笼的细胞定位的不同(图3a)。作为小分子的抗癌药,CPT只能在细胞质内分布,而且由于其水溶性极低,很难进入到细胞,从而显示出较弱的荧光信号。与之相反,PCC-1在包裹了CPT之后,主要分布在细胞核内,并且显示很强的荧光信号(来源于超分子笼本身)。另一方面,水溶性较好的带有正电荷的RB染料是一个线粒体染色剂,一般会聚集到带有负电荷的线粒体上。而RB被PCC-2包裹之后,在细胞质内呈现均匀分布,这可能是由于超分子笼表面较高的负电荷使然。而作为一个中性染料,NR是脂质体染色剂,一般会在细胞内显示一颗颗球型的荧光亮点。而RB被PCC-3包裹后,显示全部附着在细胞膜外壁上。这可能是由于PCC-3表面正电荷,更倾向于与细胞膜表面的负电荷项吸引,从而得到了截然不同的分布。值得一提的是,这些电荷导向性的细胞器靶向作用,与之前报道的金纳米颗粒的分布规律是不同的。从药物传递角度来讲,超分子笼对于传统传递手段是一个很好的补充。之后,作者还通过使用PCC-1包裹不同颜射的染料,研究共定位,进一步确认细胞核的靶向定位确实是PCC-1的特性(图3b)。最后,他们还使用荧光显微镜,对三种不同超分子笼进入细胞的过程进行了实时影片记录(图3c)。
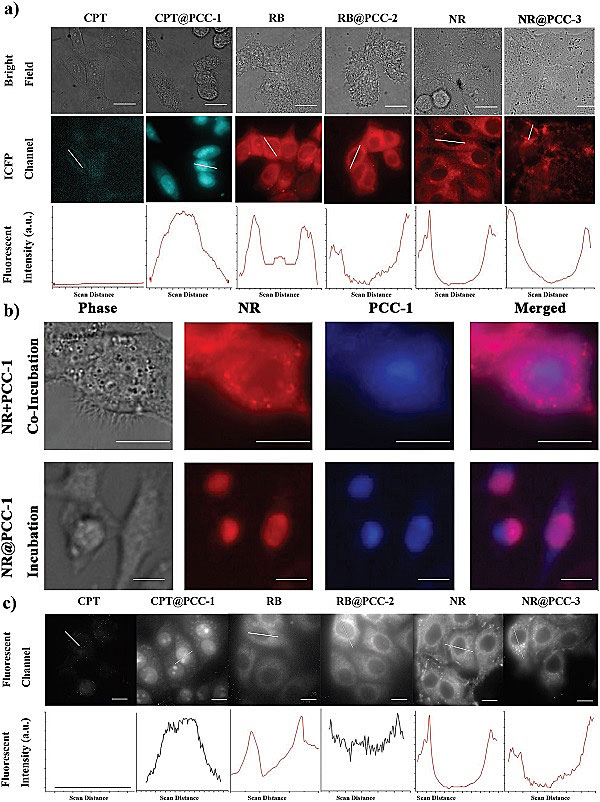
图3.(a)客体与超分子笼的细胞定位。(b)不同颜色染料的共定位。(c)荧光显微镜研究细胞内传递。图片来源:Small
最后,作者选择了癌细胞(HeLa细胞),研究了三种超分子笼在抗癌方面的表现(图4)。首先作者将三个空超分子笼与细胞培养,发现细胞存活率都很高(大于90%)(图4a)。之前的研究很少针对含金属的组装体本身的细胞毒性进行研究,这个工作可以一定程度上消除一些疑惑。当然,这些金属配位结构跟完全无毒的可溶性聚合物等材料相比还是表现了一定的细胞毒性,作者也表示更低毒的超分子笼正在继续开发中。在这三种超分子笼都包裹了抗癌药CPT后,继续研究了细胞器定位跟抗癌效果的关联。他们发现,只有能把CPT运输到细胞核的PCC-1表现出抗癌活性的提升,其他两种超分子笼因为没有把药物运送到产生药效的位置,对抗癌活性并没有起到任何的提升作用(图4b)。值得一提的是,与不使用任何药物传递技术相比,CPT通过PCC-1包裹和运输药效提升了5倍以上。

图4. (a)超分子笼本身的细胞毒性。(b)包裹了抗癌药的超分子笼的毒性,以及与单独抗癌药的对比。图片来源:Small
——总结——
作者使用了可以调控电荷的超分子配位笼作为药物载体,研究它们在细胞内细胞器定位以及抗癌活性的表现。这是超分子笼首次完整研究其细胞内运输路径,以及深入了解“纳米-生物”界面和作用关系的工作。虽然超分子笼的生物医学应用方面的研究还很少,但这些材料所具有的纳米抗癌、药物传递以及新型基因和免疫疗法的潜力,使得笔者希望今后能看到越来越多这方面的研究。同时,也期待这些新型药物载体能真正运用到临床抗肿瘤的研究上来。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Investigating Subcellular Compartment Targeting Effect of Porous Coordination Cages for Enhancing Cancer Nanotherapy
Yu Fang, Xizhen Lian, Yanyan Huang, Guo Fu, Zhifeng Xiao, Qi Wang, Beiyan Nan, Jean-Philippe Pellois, Hong-Cai Zhou
Small, 2018, DOI: 10.1002/smll.201802709
导师介绍
周宏才
http://www.x-mol.com/university/faculty/50101
Jean-Phillippe Pellois
http://www.x-mol.com/university/faculty/50102
(本文由叶舞知秋供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号