谭蔚泓教授团队Angew:核酸适配体胶束的变革
DNA-嵌段共聚物胶束(DNA-Block-Copolymer,DBC)具有可修饰的核酸序列和可控的组成结构,作为生物友好型材料已用于多项生物医学分析领域的研究。然而,其复杂和低效的合成仍然是困扰研究人员的一个阻碍。相比于传统的DBC,DNA-脂质体胶束(DNA-Lipid Micelle)利用经典的固相合成DNA技术,将脂质体-亚磷酰胺(phosphoramidite)接在DNA序列的5'端,解决了两亲性高分子共聚物合成效率低的缺点,降低了潜在的细胞毒性隐患,同时增加了细胞膜的通透性和生物相容性。基于此,佛罗里达大学化学系和湖南大学的谭蔚泓教授(点击查看介绍)实验室创新性地将核酸适配体(aptamer)与脂质体相连形成胶束,并发表了多篇文章,报道了此类胶束在细胞内成像以及靶细胞治疗方面的工作(Proc. Natl. Acad. Sci. USA, 2010, 107, 5; Chem. Eur. J., 2010, 16, 3791; Angew. Chem. Int. Ed., 2013, 52, 2012; Chem. Sci., 2016, 7, 6041)。
但是,脂质体的使用是一把双刃剑,与细胞膜磷脂相似的结构也为其带来了随意嵌插膜表面的问题,继而浪费了核酸适配体对靶向癌细胞的选择性。为了解决这个问题,谭教授领导的团队利用甲基丙烯酰胺(methacrylamide)能够在紫外光下交联的特性,将其放入核酸适配体和脂质体中间,使新的两亲分子单体具有可交联的能力,进而创造出更加稳定的核酸适配体-脂质体胶束,该胶束也被证实拥有更专一的癌细胞靶向性。
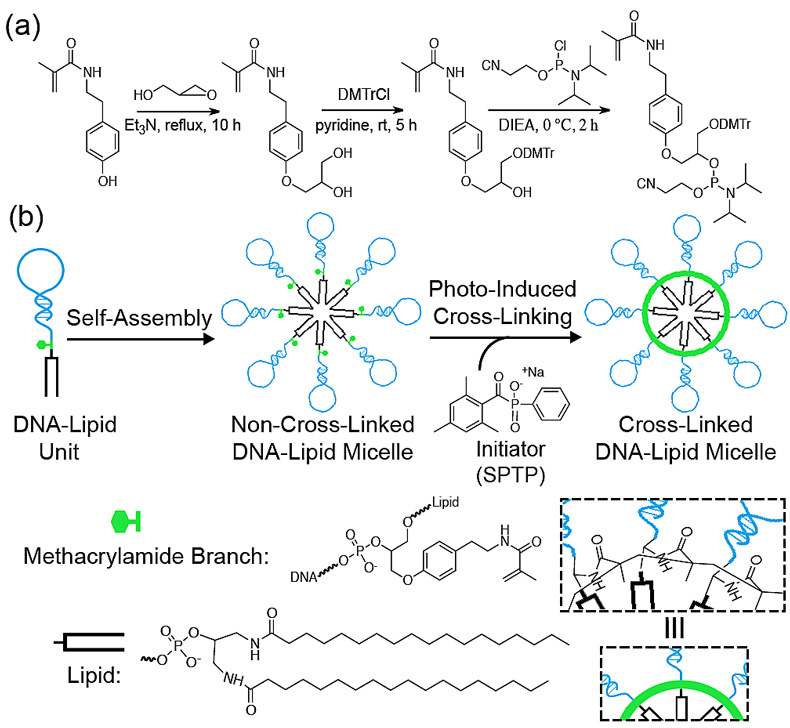
图1. 光引发胶束交联的过程
研究者首先合成了脂质体-亚磷酰胺和包含DMTr的甲基丙烯酰胺-亚磷酰胺,利用DNA固相合成,最重要的丙烯酰胺部分即可嵌插在DNA和脂质体之间。该两亲性单体可在溶液中自发形成18 nm左右的胶束。随后,一种生物相容性很好的聚合引发剂SPTP加入到溶液中,在365 nm的紫外光照射下,15分钟后胶束即可交联成功。
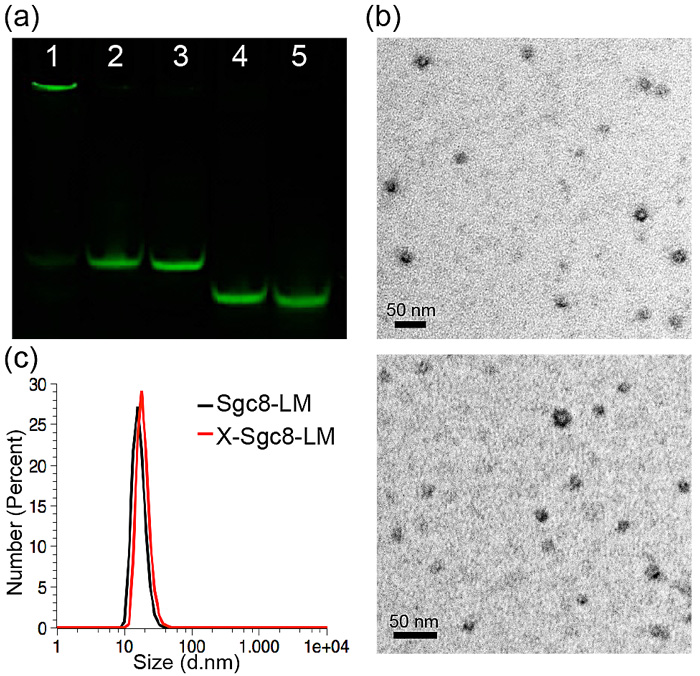
图2. 交联前后DLS和TEM显示胶束的物理性质并没有改变
交联反应并没有改变胶束的大小或形貌,反而增强了胶束对抗DNA酶和血清降解的能力,可能是由于胶束表面大量的核酸适配体形成了一定的空间位阻,阻挡了酶的接近,而交联进一步增强了结构稳定性,使单体不易弥散而让酶趁虚而入。
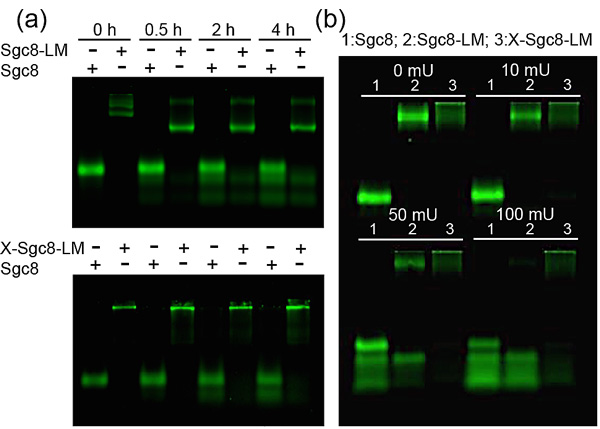
图3. 交联后胶束抵抗血清和DNA酶降解的能力显著提高
另外,在没有交联的情况下,高浓度的核酸适配体-脂质体并不能很好地识别靶向的癌细胞,而交联后的脂质体又重新夺回核酸适配体的特异性的识别能力。
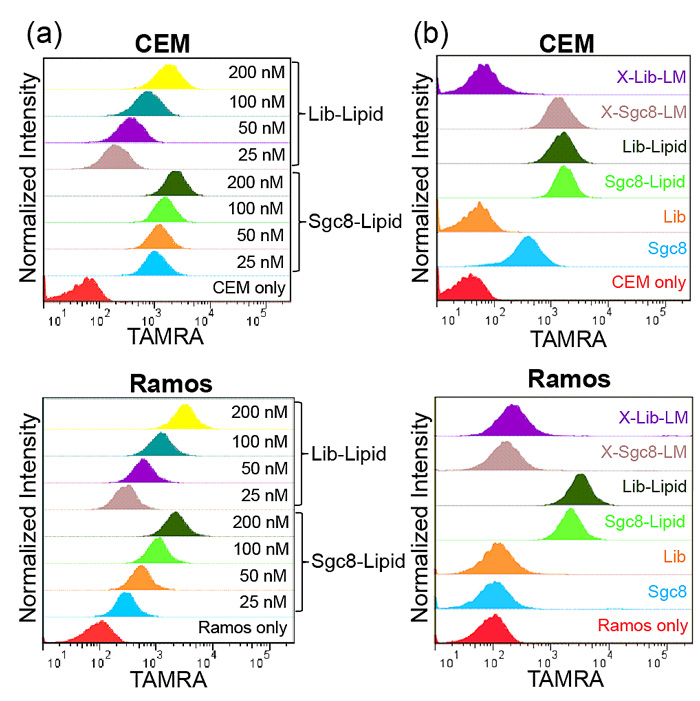
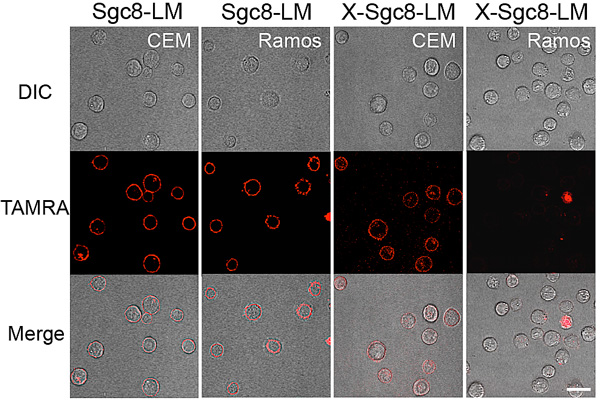
图4. 流式和共聚焦结果表明交联后的核酸适配体胶束特异性识别靶细胞的能力增强
稳定性和专一性的提高结合胶束本身可载药和生物相容的特性,使此类核酸适配体胶束在生物分析和癌症治疗方面拥有令人期待的应用前景。这一成果近期发表在Angewandte Chemie International Edition 上。
该论文作者为:Xiaowei Li, C.& Adrian Figg, Ruowen Wang, Ying Jiang, Yifan Lyu, Hao Sun, Yuan Liu, Yanyue Wang, I-Ting Teng, Weijia Hou, Ren Cai, Cheng Cui, Long Li, Xiaoshu Pan, Brent S. Sumerlin, and Weihong Tan
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Cross-Linked Aptamer–Lipid Micelles for Excellent Stability and Specificity in Target-Cell Recognition
Angew. Chem. Int. Ed., 2018, DOI: 10.1002/anie.201804682
导师介绍
谭蔚泓
http://www.x-mol.com/university/faculty/10092
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
发夹型核酸级联放大反应提高活细胞内信使RNA成像信号 2015-05-06
-
内建DNA反应网络的智能原型细胞 2018-09-13
-
功能化DNA水凝胶在生物分析和生物医学领域中的应用 2016-05-13
-
仿生膜表面的DNA纳米结构组装/解组装:生物材料间的分子调控 2018-03-01
-
Tuning the Cross-Linking Density and Cross-Linker in Core Cross-Linked Polymeric Micelles and Its Effects on the Particle Stability in Human Blood Plasma and MiceTobias A. Bauer, Irina Alberg, Lydia A. Zengerling, Pol Besenius, Kaloian Koynov, Bram Slütter, Rudolf Zentel, Ivo Que, Heyang Zhang, Matthias Barz
-
Polymeric ionic liquids and MXene synergistically improve proton conductivity and mechanical properties of polybenzimidazole-based high-temperature proton exchange membranesInternational Journal of Hydrogen Energy (IF 8.1) Pub Date : 2022-12-20 ,DOI:10.1016/j.ijhydene.2022.11.213Di Yu, Yinghe Cui, Shuang Wang, Xiaodong Wang, Zhipeng Yong, Han Sun, Xiaorui Wang, Chenglong Li, Feng Pan, Zhe Wang
-
pH/redox-responsive core cross-linked based prodrug micelle for enhancing micellar stability and controlling delivery of chemo drugs: An effective combination drug delivery platform for cancer therapy.Hailemichael Tegenu Gebrie,Kefyalew Dagnew Addisu,Haile Fentahun Darge,Yihenew Simegniew Birhan,Darieo Thankachan,Hsieh-Chih Tsai,Szu-Yuan Wu
-
Core Cross-Linked Polymeric Micelles for Specific Iron Delivery: Inducing Sterile Inflammation in Macrophages (Adv. Healthcare Mater. 19/2021)Tobias A. Bauer, Natalie K. Horvat, Oriana Marques, Sara Chocarro, Christina Mertens, Silvia Colucci, Sascha Schmitt, Luca M. Carrella, Svenja Morsbach, Kaloian Koynov, Federico Fenaroli, Peter Blümler, Michaela Jung, Rocio Sotillo, Matthias W. Hentze, Martina U. Muckenthaler, Matthias Barz
-
Core Cross-Linked Polymeric Micelles for Specific Iron Delivery: Inducing Sterile Inflammation in MacrophagesTobias A. Bauer, Natalie K. Horvat, Oriana Marques, Sara Chocarro, Christina Mertens, Silvia Colucci, Sascha Schmitt, Luca M. Carrella, Svenja Morsbach, Kaloian Koynov, Federico Fenaroli, Peter Blümler, Michaela Jung, Rocio Sotillo, Matthias W. Hentze, Martina U. Muckenthaler, Matthias Barz


































 京公网安备 11010802027423号
京公网安备 11010802027423号