诺奖弟子跟你聊聊“定向进化”那些事
采访及整理:丁霄哲
2018年,诺贝尔化学奖迎来了历史上第五位女性得主——加州理工学院的Frances H. Arnold教授,以表彰她在“酶的定向进化”这一领域的贡献。George P. Smith教授和Gregory P. Winter爵士因在“多肽和抗体的噬菌体展示技术”领域的贡献,共享了此次诺贝尔化学奖(点击阅读相关)。

Frances H. Arnold教授。图片来源:Arnold教授课题组
为了让大家更好地了解Arnold教授的贡献,我们采访了Arnold教授课题组的博士生陈凯,请他介绍这次荣获诺奖的工作、它的历史和应用,以及实验室在这次得奖后的一些趣事。在诺奖委员会为今年化学奖撰写的Scientific Background 所引用的一系列论文中,陈凯同学是其中三篇论文的主要贡献者之一 [1-3],这三篇论文我们也曾进行过详细解读(报道一、报道二、报道三)。
提问:在正式开始采访之前,我们先聊一些轻松的话题,给我们讲讲你对Arnold教授这次拿诺奖的感受?
陈凯:其实,Frances这次拿奖真的是让我们又意外又惊喜。意外是情理之中的“意外”,Frances在拿诺奖之前已经拿了太多重量级的奖项,这其中就有“千禧技术奖(Millennium Technology Prize)”——堪称工程界的“诺奖”并且半数以上该奖项的得主最终都被授予了诺奖,还有“美国国家科技创新奖(National Medal of Technology and Innovation)”等近数十个奖项。正是因此,经常有人预测Frances完全有拿诺奖的可能,但Frances并未想象过诺奖会来得如此突然。甚至,在之前聊起诺贝尔化学奖时,Frances仍感叹有不少完全当得起诺奖殊荣的先驱前辈如今却还未获奖,比如同是加州理工学院教授的Harry B. Gray和John E. Bercaw,一个是生物无机领域的先驱,一个是金属有机以及碳氢键活化领域的前辈。
两年前,加州理工学院给Frances重新以Linus Pauling讲席教授冠名。在诺贝尔奖史上,仅四位科学家被授予了两次诺奖,加州理工的Linus Pauling(鲍林)就是其中之一(1954年的化学奖和1962年的和平奖),所以,以Pauling冠名的讲席教授分量之重也可见一斑。或许在那时,加州理工学院就期许着有朝一日Frances能像Pauling那样被授予诺奖桂冠——当然,这都是我的“马后炮”,哈哈……其实,就在诺贝尔化学奖公布的十天前,诺奖官方twitter曾点评了Linus Pauling的生平。Frances作为加州理工以鲍林冠名的讲席教授转推了这一条并写了一句评论,“I have a rather small foot for these shoes. Sigh”,直译就是“我的脚太小,还没法穿这样的鞋”,她谦虚地认为自己的教授头衔虽包含“Linus Pauling”,但与Linus Pauling相比还远远不够。谁知几天后,“诺奖”真的来了,实验室成员便调侃Frances——“@francesarnold it looks like your feet grew this week!”(“Frances,看来这一个星期你的脚就长的足够大了”)——“Evolution made it possible!”(“进化让它成为可能!”)。
提问:看来你们实验室师生关系非常和谐。那我们进入正题,先给大家简单解释一下“酶的定向进化”到底是什么?
陈凯:这里有三个点,“酶”、“进化”还有“定向”。首先,大家应该都知道酶是生物体中负责催化功能的大分子(其中,超过99%的酶都属蛋白质),细胞内几乎所有生存、复制所需的代谢过程都需要各种不同的酶催化进行以持续生命。
生命从最初的单细胞生命到如今纷繁复杂的生物种群无时不刻没有发生着演变过程——达尔文的进化论阐释了这个现象,环境的改变淘汰了不适者——还有一些个体通过自身的改变适应了环境,甚至能得益于新的环境,而存活下来。在生物学上,我们往往讨论“基因型”和“表现型”,“基因型”指的就是生物体的基因,生物个体功能的表观形态就是“表现型”。贯穿这之间的,就是高中的生物课所描述的“中心法则”——蛋白由生物体的基因表达得到。所以,基因的突变导致了酶的变异,其性能或者行使的功能也可能随之发生变化,从而在自然选择的结果下,便有了“进化”。
进化拥有两个基本要素——突变与选择——突变是随机的,选择则是可以有方向性的。自然的进化需要千百万年的时间,而选择的结果也依赖于不断变化的环境因素。而人类在应用自然选择来实现自己的目的时,则会施加一个恒定的方向,所以是“定向”的。
把这三点结合起来,就是“酶的定向进化”,指通过快速随机突变结合高效的筛选来实现短时间内有目的的优化或者改造酶的功能。
提问:相比于其他化学品而言,酶在生活中反倒是不常听到,为什么要对酶进化?
图片来源:pharmanewsonline
陈凯:酶在人类社会,从日常到工业,无一不在,只是普通人不太了解。日常用的洗衣粉中,有的就含有酶,促进油污等污渍的分解;食品工业上的发酵、降解等过程中,酶更是必不可少;药物以及精细化工中酶作为绿色高效催化剂已经替代了传统化学中一些需要重金属参与且高耗能的生产过程;此外,酶更是生物能源发展中最为重要的角色。可以说,酶之所以能有这么广泛的应用,完全是得益于“定向进化”。
如前所说,不同的酶都有所属的生物体,它们是为了执行生物体内的相应过程而产生的。一旦脱离了原始的生物体环境,在体外甚至对酶本身具有伤害的环境中,酶在绝大多数情况下无法发挥其原本的性能。不同的温度、酸碱度(pH)、盐浓度、有机溶剂等等外在条件会极大程度影响酶的稳定性、催化活性以及选择性;而且单一的酶往往局限在单一的底物,难以普适使用。为攻克这些弊端,酶的定向进化成了必要的手段——通过引入随机突变提高酶的性能。
提问:可以说说Arnold教授最早是怎么想到要做“定向进化”的?
陈凯:从1986年Frances在加州理工学院开始自己独立的研究工作起,Frances就着眼于通过改造蛋白结构以优化甚至创造(新的)蛋白功能。当时的主流科学家普遍认为,应该对蛋白的结构与功能之间的联系有清晰的认识,从而基于这些认识去设计更优的蛋白结构。然而,Frances却反其道而行之,认为蛋白作为一个大分子过于复杂,并且由于缺乏研究手段,人们是不可能在短时间内从原子层面上对蛋白内部的精细结构以及蛋白在执行功能时的变化有深入的认知,而在此基础上做完整的设计几乎是不可能的。果不其然,即便在今天,人们虽然已经能够利用发达的计算机技术设计全新的蛋白,但是仍需要依赖“定向进化”的手段重新优化设计出来的蛋白使其性能能够匹敌自然界已存在的蛋白。
当时,Frances这一反潮流的论断被绝大多数的从事生物/化学研究工作的科学家所不接受。科学界的不同意见并没有让Frances停住脚步,她告诉当时的人们,“我是个生物工程学家,我只关心我能不能把蛋白改造得更好,我并不在意我对蛋白理解得是否足够透彻”。
提问:可以具体介绍一下酶的定向进化最早期的奠基性工作的内容吗?
陈凯:“定向进化”最早期的里程碑式工作,由Arnold课题组的博士后成员陈克勤(Kevin Chen)参与完成[4, 5]。此研究展示了“定向进化”这一策略用于解决酶在体外环境中稳定性以及催化活性问题的强大功能。
在非自然的环境中,比如含有高浓度大极性有机溶剂的破坏性环境中,酶的稳定性往往会受到很大影响。而在工业化生产中,酶又往往需要在有机溶剂中发挥催化作用——这一工业需求随之带来一个问题——能否通过调整蛋白结构提升酶在有机溶剂中的稳定性,从而保证甚至提高其催化活性?蛋白酶subtilisin E可用于水解酪蛋白(casein),但其在有机溶剂N,N-二甲基甲酰胺(DMF)中的稳定性极差,导致其在60%DMF溶液中的催化活性不足在100%水溶液中的活性的0.5%。他们在表达该蛋白酶的基因中引入随机突变,得到表达相应突变体酶的菌落,并快速筛选出了催化活性更高的突变体。通过数轮进化,他们得到了在60%DMF溶液中的催化提高了256倍的subtilisin E突变体!这个活性水平与subtilisin E 在水溶液中的活性水平相当(图1)。基于此工作,Frances提出了“定向进化”这一概念——通过一定程度上模拟自然进化与选择的过程,实现对蛋白引入有益突变,从而改造蛋白功能。

图1. 对于subtilisin E的定向进化。图片来源:参考文献 [6]
提问:能概括地说一下,Arnold实验室验证的“定向进化”是怎样一个流程吗?
陈凯:“定向进化”的整个工作流程分4步(图2):1)针对目标功能确立初始蛋白以及对应的基因,通过不同的手段在蛋白对应的基因上引入突变以实现序列全局的一小部分覆盖;2)将突变基因转送至细菌,使得每个不同的突变体基因得到一一分离,相应的突变体蛋白在细菌中也得以表达;3)使用不同的测试方法筛选出具有更好目标性能的蛋白突变体,并通过测序手段确定其基因与蛋白序列;4)以获得的最优突变体为母本,进入下一个“突变-筛选”的循环,直至达到预期的蛋白性能。
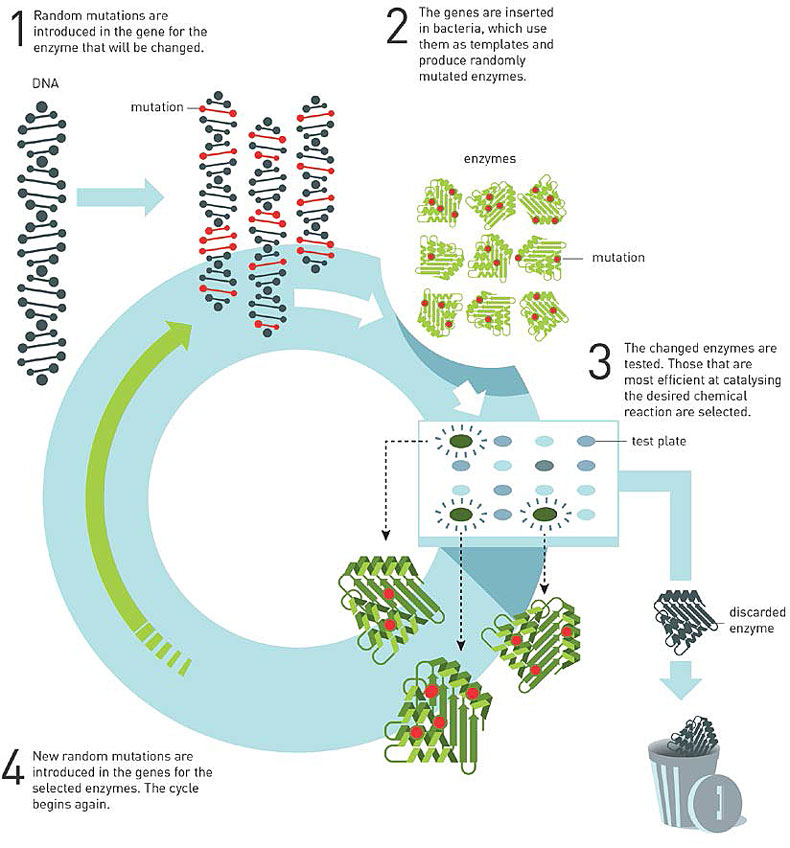
图2. “定向进化”的基本流程。图片来源:Scientific Background on the Nobel Prize in Chemistry 2018
提问:除了提升酶的稳定性,“定向进化”还能改造酶的什么性能?
陈凯:酶的绝大部分性能都能通过定向进化被改造。其中,酶的催化活性往往是人们最为关注的点。酶在生物体内,往往只对个别底物催化特定的反应,这也就是所谓的酶的特异性(specificity)。然而,很多时候,酶也具有混乱性(promiscuity),也就是说,如果给酶提供一个在结构上与天然底物具有相似性的非天然底物,有时候酶也会体现出催化活性,但是这样的催化活性,往往是非常低的。而“定向进化”则可以利用酶的混乱性这一性质,使得酶的适用范围得到数量级的提升。如图3所示,当酶对非天然底物表现出非常低的活性之后,“定向进化”可以得到突变体,对该非天然的底物表现出相当高的活性。虽然这样的进化往往需要非天然底物与天然底物在结构上具有相似性,但是基于新的突变体,又可以对新的底物进行“定向进化”,周而复始,使得酶的底物范围得到大规模的扩展——这一过程称之为“底物攀行”(substrate walking)。
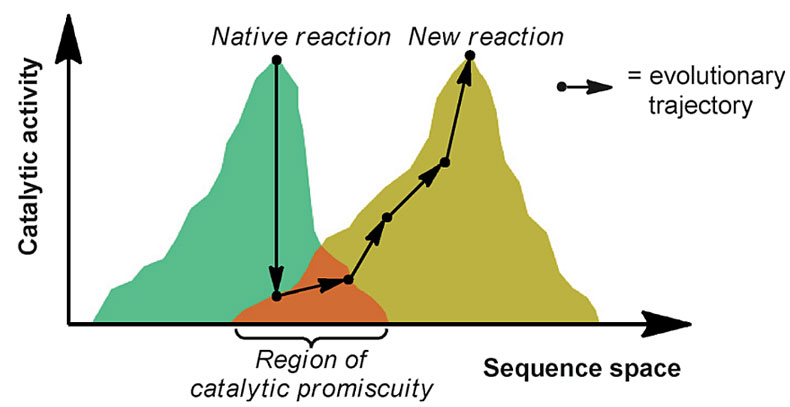
图3. 酶的催化混乱性与定向进化。图片来源:参考文献 [7]
提问:能介绍一下Arnold实验室“定向进化”的主要成果有哪些?
陈凯:在实验室目前的一个研究方向中,“定向进化”改造了天然的色氨酸合成酶,使之能有极其广泛的底物普适性,可用于高效合成在生物学、药物开发领域的重要意义非天然氨基酸(图4)。生物体内,色氨酸合成酶由两个蛋白区TrpA和TrpB复合而成,两者缺一不可。通过“定向进化”,课题组得到了一个TrpB的突变体,它可不依赖于TrpA实现催化功能 [8];后续的进化得到了更多的突变体,可用于高效、快速、大规模的合成不同类别的非天然氨基酸 [9]。这一策略已被药物研发公司的巨头默克(Merck)公司采用,用于几十到上百公斤级非天然氨基酸的生产。
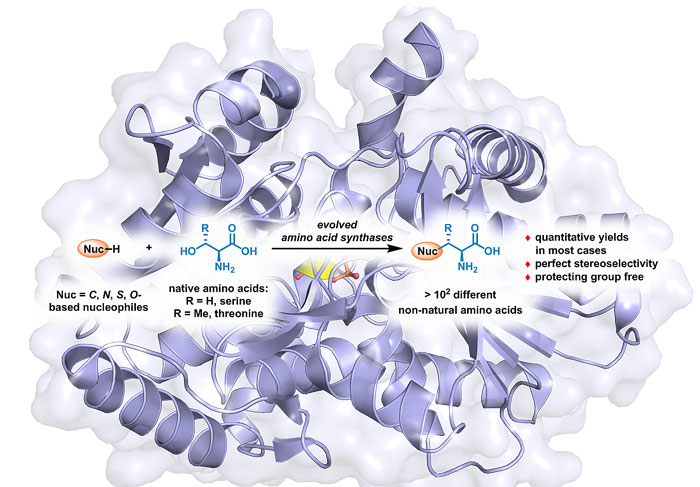
图4. 生物催化用于非天然氨基酸的合成
“定向进化”不仅仅针对单一的酶进行,还可以对一些重要天然产物的生物合成途径中的不同的酶同时进行。在Arnold课题组的工作中,他们曾对类胡萝卜素的生物合成途径中的酶(包括去饱和酶、环化酶等)做了定向进化。改造后的代谢途径(metabolic pathway)可以用于不同类胡萝卜素天然产物的合成,其中,还实现了圆酵母素(torulene)在大肠杆菌体内的首次生物合成 [10]。
“定向进化”也被Arnold课题组用在了生物燃料的合成。异丁醇被认为是极具优势的生物燃料,有潜力代替现有的化石燃料。代谢工程为以葡萄糖为原料的异丁醇生物合成提供了一条解决方案。葡萄糖酵解生成丙酮酸的过程中生成大量的还原型辅酶I(NADH),而丙酮酸转化为异丁醇的过程中需要的酶却只以还原型辅酶II(NADPH)为能量源——因此,在还原型辅酶利用上的失衡导致了异丁醇生物合成在经济性上的巨大问题。Arnold课题组随即利用了“定向进化”解决了这一问题,他们改造了丙酮酸转化为异丁醇的过程中需要的酶,使之能够利用糖酵解过程中生成的NADH,并且实现了该代谢途径下异丁醇以100%理论产率的合成 [11]。这一技术也被工业化用于大规模生产异丁醇。
Arnold课题组还在酶参与的氧化反应上有着突出的成就,也用在生物燃料合成。细胞色素P450(cytochrome P450)是他们着重研究的氧化酶。细胞色素P450是一类含有铁卟啉辅酶(血红素)的氧化酶,在生物体内的代谢途径中起着重要作用,参与催化氧化代谢产物抑或降解毒性的外源分子。若能利用这一氧化功能,高效的催化氧化普通烷烃得到相应的醇,因此能为合成生物燃料提供又一条绿色环保的途径。然而,越是简单的烷烃,其生物氧化越难:与天然的底物不同,烷烃本身在酶的活性中心的结合力不强;再者,越是短链的烷烃,其对应的碳氢键越是难被打断。“定向进化”往往可以解决这样的困难,进化后的P450氧化酶可以高效的催化氧化从长链到短链的各类烷烃 [12]。除此之外,P450催化氧化烯烃底物时,自然进化的工作机制下,往往只得到氧杂环丙烷的产物;而“定向进化”可以使酶打破这一铁则,让反应另辟途径——Arnold课题组去年完美印证了这一点,进化后的P450氧化酶催化氧化烯烃成醛 [13]。
提问:听说最近几年你们使用酶实现了许多化学上都挺难实现的反应,你自己也参与了其中几项工作。可以具体介绍一下吗?
陈凯:确实如此。我们实验室在近几年试图进一步打破对酶促化学的传统认识,并展现了酶更具潜力的应用前景。传统上,人们对酶的混乱性的认识总是局限在不同的底物但属同一类反应。基于对P450氧化酶的深刻认识,他们从反应机理着手做相似性类比,引入了不同的反应类型——本质上,氧化反应是氧转移(oxo transfer)的过程,类比之下,P450是不是也能实现氮转移(nitrene transfer),甚至碳转移(carbene transfer)的过程呢?近五年来自我们实验室大量的工作已经证明了这一点(图5)。虽然野生型的P450抑或其他的血红素蛋白往往体现极低的催化活性,甚至很多时候难以完成一次催化循环(<1 turnover),但“定向进化”往往是解决酶的催化活性问题的最佳策略。往往只需要几轮的进化,这些酶的催化活性就能得到指数型的增长。通过模拟氧转移形式下的烯烃环氧化反应,氮转移和碳转移之下的氮杂环丙烷化[14]和环丙烷化反应[15] 均得以高效的实现;氧转移形式下的烷烃羟基化反应对应的氮转移和碳转移形式也得以在各类反应中实现,比如烷烃的氨基化[16]、烷烃的烷基化以及碳硅键[2] 和碳硼键[3]的形成——也是首次在生物体内形成这些非天然化学键。今年,我们利用“定向进化”策略以及这一套酶促体系又达到了新的高度,实现了在传统化学上都难以合成的高能高张力小分子碳环的生物合成[1]。这其中一部分化学也已经被应用到了制药工业中,用于高选择性高效率制备药物中间体中。
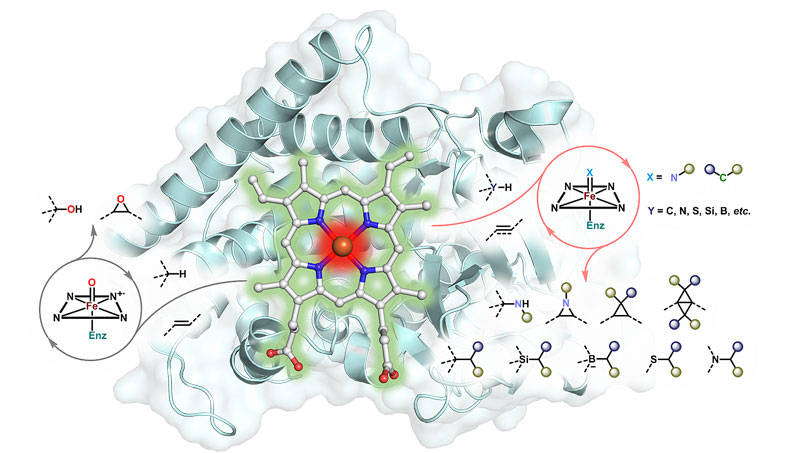
图5. 基于反应机制的铁卟啉蛋白的化学混乱性
提问:除去Arnold实验室的工作,能再给个在工业应用中“定向进化”的代表性例子吗?
陈凯:当然。在工业制药领域,酶的“定向进化”最为突出一次胜利当为转氨酶(transaminase)的进化与使用。2010年,Merck公司在Science 发表了转氨酶的“定向进化”在绿色合成2型抗糖尿病药物“西他列汀”(Sitagliptin, 2016年销量:2.3亿美元)中的使用(图6)[17]。与化学催化方法相比,进化后的转氨酶用于“西他列汀”的合成在产率上提升了10–13%,立体选择性几乎完美(99.95% ee),日产量增长了53%,工业废料减少了19%,避免了重金属的使用,缩短了反应步骤,无需高压条件以及高压设备,大幅降低了工业生产成本。
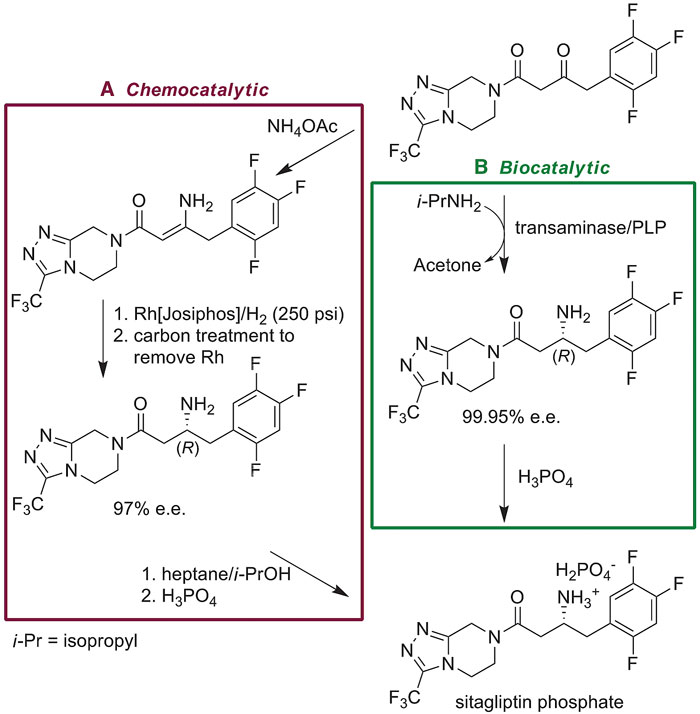
图6. 西他列汀的化学合成与生物合成。图片来源:参考文献[17]
此外,有的读者可能也听说过DNA聚合酶、限制性内切酶、连接酶等分子生物学中常用的工具,它们无一例外都经历了许多轮的定向进化才得到如今优良的性质。
提问:那给我们讲讲“定向进化”在技术层面是怎么做到的?
陈凯:其实,与自然进化类似,“定向进化”这一项技术中,最关键的步骤还是“变异”和“筛选”(或“选择”)。有控制有效率的突变和快速简洁的筛选是“定向进化”的核心。
提问:那是怎么实现变异的呢?
陈凯:引入突变的技术主要分为两类——点突变和DNA重组。许多实验室都在其中有所贡献。
在Frances的开创性工作中所使用的通过“易错型”聚合酶链式反应(error-prone PCR)引入随机突变,由David V. Goeddel于1989年发展,也是最为常用的随机点突变,并由不同实验室发展不同的策略来通过控制DNA复制扩增时“出错率”从而在整个基因的不同位置随机引入突变。
Error-prone PCR也存在固有的不足,比如突变在很多情况下是有选择性的(例如:赖氨酸(密码子AAA或AAG)到半胱氨酸(密码子TGT或TGC)这样需要多个连续碱基变化的突变几乎是不可能发生的),而且有时候需要筛选大量的突变体才能得到有效突变的个体。因此,如果已知蛋白结构中的一些位点对于蛋白功能具有关键作用,则可以选用定点的饱和突变(site-saturation mutagenesis,即通过在指定的基因序列位点引入简并密码子(degenerate codon)从而在特定的蛋白位点随机引入20种天然氨基酸),可提高突变的导向性和筛选效率。其后,Manfred T. Reetz提出了“22密码子策略”(22-condon trick),更好地均衡20种氨基酸出现的几率。
许多蛋白往往具有同源性,被归类在同一蛋白族系,它们在氨基酸序列以及三维结构上具有很大的相似性。同源蛋白的基因进行分切,由于部分基因的同源性,碎片基因可以实现错配杂交,从而引入突变,融合得到新的基因,该过程称为DNA改组(DNA shuffling),由Willem P. C. Stemmer在1994年发展并广泛应用在“定向进化”之中,只可惜Stemmer在2013年不幸去世,否则,以其在该领域的贡献应当共享诺奖殊荣(由Frances本人评价)。类似于DNA shuffling,Frances早年的学生赵惠民(Huimin Zhao)发展了DNA交错延伸技术(staggered extension process),可以避免DNA shuffling过程中,基因片段的单独合成和纯化。
除却以上提及的“突变”手段,值得说明的是,如今随着DNA合成成本的降低,开始有越来越多的蛋白质工程师们直接用合成DNA的方法直接引入确定位点、确定密码子比例的点突变,或是基于一定理性设计的同源重组突变体文库,比如,SCHEMA程序设计以蛋白二级结构为基础,尤其是对同源性较低但有相似的蛋白折叠的母体蛋白的shuffling能得到高质量的蛋白突变体文库用于筛选。
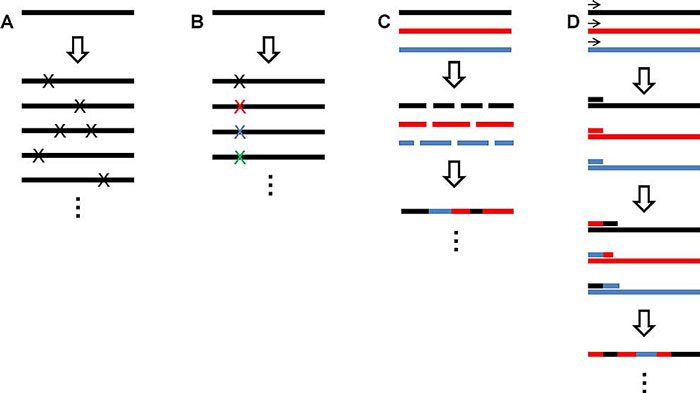
图7. 引入突变的方法: A. 通过error-prone PCR的随机突变;B. 定点饱和突变;C. DNA改组;D. DNA交错延伸。图片来源:参考文献[18]
提问:有了突变体文库,又怎么筛选出符合条件的突变体的呢?
陈凯:常用的方式分两类,它们的名字很像,一类叫筛选(screening),另一类叫选择(selection)。筛选以各种物理分析手段为主(例如光学性质),选择往往以生物表型为判断依据(例如营养缺陷)。
提问:“筛选”是怎样操作的?
陈凯:基于不同的表型特征以及筛选通量的要求,筛选突变体的方法千差万别(图4)。以物理光学特性为依据的检测手段,可以实现非常高通量的筛选。以上述Frances的早期工作为例,蛋白酶在DMF中的催化活性是筛选的标准,在含有反应底物酪蛋白与DMF的培养基上,菌落在表达目标酶的突变体后,催化酪蛋白水解使在菌落周围显现出光晕,酶活性高低直接反映光晕的大小上。除此之外,针对不同的表现形式,还可以通过颜色、紫外吸收、荧光、浑浊度、透明度等物理特性来筛选蛋白。Arnold课题组在1996年的工作中,研究了通过“定向进化”提升酯水解酶在高有机溶剂含量的溶液中的活性,其中对硝基苯酚酯为研究的模型底物,在其发生水解后生成的对硝基苯酚在405 nm的紫外波段有特征吸收,该波段的紫外吸收强度直接反映了水解酶的活性[19]。
但上述例子中的筛选手段也存在缺陷,底物太过于特殊,在“定向进化”之后往往需要再此验证得到的突变体是否也对其他底物提高了催化效率。针对不同的催化反应,如果产物中形成了特殊官能团(比如醛),也可以通过对该官能团的快速显色法实现高通量筛选(例如:Arnold课题组在2013年的工作[20])。此外,如果没有可利用的光学性质或辅助显色,其他的分析技术,如核磁共振(NMR)、高效液相色谱(HPLC)、气相色谱(GC)、质谱(MS)等均可用于筛选,但筛选通量往往受到限制,多适用于筛选小规模的蛋白突变体库。

图8. 筛选突变体的方法。图片来源:参考文献[21]
在进化除酶以外的功能性蛋白时,或可根据蛋白本身的性质或可借助其他生物分析手段进行筛选。Roger Y. Tsien等通过对绿色荧光蛋白(GFP)进行定向进化,得到了不同荧光波段的荧光蛋白 [22];Arnold课题组使用了“定向进化”技术改造了光敏感通道蛋白(channelrhodopsin),使之有不同的激发波长[23]——这些蛋白的进化,往往可以根据其本身光学特性进行快速筛选。对于重组蛋白、伴侣蛋白甚至结合肽等其他类型的蛋白或片段的进化,荧光激活细胞分选技术(fluorescence-activated cell-sorting)或结合酵母展示技术,可作为非常高效的筛选手段。
提问:“选择”听上去比“筛选”会更简单一些?
陈凯:是的,“选择”不像“筛选”需要对每个突变体个体都进行或多或少的分析研究,而往往先是有选择性的直接筛除相当一部分失去活性的突变体。今年化学诺贝尔奖的另一部分颁给了“噬菌体展示”(phage display)用于结合蛋白或者抗体的定向进化,这便是“选择”中的一类——拥有结合能力的蛋白突变体(与相对应的编码基因之间存在连接)能够被固载的结合目标给捕获,而失去结合能力的突变体直接被冲刷除去,从而选择高结合能力的突变体。与“噬菌体展示”类似,“细胞表面展示”(cell surface display)、“核糖体展示”(ribosome display)、“信使RNA展示”(mRNA display)等策略也用于类似的结合蛋白的进化之中。
在设计“选择”方法时,一个常用的技巧是人为地给有机体加入生存环境上的选择压力,并使蛋白的“定向进化”所带来的影响直接导致有机体赖以生存的必要因素的改变。这样,就只有具有特定性质的“适合环境”的突变体会被保留下来。
最为常见的,当属“抗生素耐受”这一表型,体现在进化具有中和抗生素能力的酶这一类工作中。“抗生素耐受”这一表型的使用远不止此,把蛋白的目标功能与抑制抗生素的基因片段的表达相结合也用在一些酶的定向进化中。比如,Peter G. Schultz为进化氨基酰tRNA合成酶(aminoacyl tRNA synthetase)使其能高效的用特定的非天然氨基酸对阻抑tRNA(suppressor tRNA)进行氨基酰化,把amber终止子(amber stop codon)放入氯霉素的抗性基因片段之中——母体大肠杆菌在氯霉素存在的环境中的存活力体现了目标tRNA合成酶的催化活性 [24]。
“营养缺陷-补给”则是另一种常见的“选择”形式,即指蛋白的定向进化可解决宿主在自身代谢上的缺陷,特别适用在代谢途径中的酶的进化。其中具有代表性的是,基于戊醛糖(xylose)代谢途径的蛋白的定向进化——以戊醛糖作为宿主的单一碳基营养源,可进化单糖转运蛋白(mono-saccharide transporters)和戊醛糖异构酶(xylose isomerase)更好的转化戊醛糖甚至用于产生能够作为生物能源的代谢物(如酒精)。此外,对DNA和RNA聚合酶的“定向进化”往往还用到更复杂的“选择”技术。
提问:除了酶的定向进化,定向进化可不可以直接应用在其他种类的蛋白质上?
陈凯:可以的,“定向进化”除了在酶催化领域中的突出贡献,还广泛应用在其他类型的蛋白的优化与改造。如前所述,Arnold课题组改造了光敏感通道蛋白(channelrhodopsin),使之有不同的激发波长,用于生物学上的研究;加州大学圣迭戈分校的Roger Y. Tsien等通过对绿色荧光蛋白进行了定向进化,得到了不同荧光波段的荧光蛋白(图8)。魏茨曼研究所的Dan S. Tawfik利用“定向进化”的手段研究蛋白折叠的机制。哈佛大学的David R. Liu对“定向进化”在技术层面进行了深入的开发,提出了噬菌体辅助的连续进化(phage-assisted continuous evolution, PACE)等技术,并用于基因编辑技术的发展上。霍华德•休斯研究所的Loren Looger等人通过“定向进化”,大幅提升了用于神经科学研究的钙离子探针的性能,使得其在数千神经科学实验室中得到广泛应用。加州理工学院的Viviana Gradinaru等将“定向进化”用于进化病毒载体的衣壳,得到了可以高效跨越血脑屏障、将DNA导入小鼠大脑的载体、未来可能可以用于基因治疗中枢神经系统疾病。类似的例子还有许多。

图9. 不同荧光波段的荧光蛋白
提问:听说在Arnold实验室的一系列重要工作中,有许多华人学者前辈都做出了关键贡献?
陈凯:是的,Arnold课题组历史上的成员中有许多华人的身影,他们做出了许多开创性的贡献,比如前面提到的陈克勤、赵惠民,还有游凌冲(Lingchong You)、林章凛(Zhanglin Lin)等。他们中的很多现在也是在生物/化学工程一线的学者:赵惠民老师现在是UIUC化学与生物分子工程系教授,在合成生物学、代谢工程、生物催化等领域都有杰出贡献;林章凛老师现在是华南理工大学生物和生物工程学院主任,在合成生物学、酶工程以及生物制药等领域建树颇多;游凌冲老师目前为杜克大学生物医药工程系教授,从事计算系统生物学和合成生物学方面的研究;陈克勤是中国生命科学领域的资深企业高管和企业家,创立并发展了多个生物制品和生物研发公司,也是中国国家发展和改革委员会所属的技术战略规划委员会成员以及中国上海浦东新区生物医药产业发展管理委员会的高级顾问。
提问:自从Arnold教授获得诺贝尔化学奖以来,已经有许多媒体报道过她“硬核”的人生经历。作为她的学生, 在你看来她有什么样的特质让她能有现在的成就?
陈凯:Frances给我留下最深的印象即是她对科学全局的审视。她往往比一般人看得远,她对科学的信念在于——科学的目的是要为人类社会的进步提供保障。Frances本科专业是机械工程,博士则是生物工程,Frances几乎没有专业训练的化学背景——如今却被授予了诺贝尔化学奖。那正是因为Frances对所有科学学科的包容,她一直处于学习的状态,她从来不排斥任意一个科学方向——比如说,遇到了很深入或者很理论的化学问题,她非常乐于坐下来听(化学背景的)学生们给她仔细讲解其中的知识。这也是为什么她能够发展“定向进化”的策略在各个方向的应用,并引领“蛋白工程”、“生物催化”等方向。正如她自己所说,她或许不是最出色的化学家,她教酶如何进化,自己也在学习中不断进步。
就像许多媒体报道过一样,Frances的人生路颇为坎坷,经历了不少亲人的离世,受过癌症的折磨,但并未让她在科研上有所中断甚至犹疑。她曾经说,她的科学之路深受她父亲的影响,她和她父亲曾是美国科学界唯一一对“父女档”工程院院士,然而她父亲却未有机会见证她如今的成就而过世,不禁也让她颇为伤感。2016年秋,Frances经受了又一次沉重的打击,她突然告诉大家她尚在念本科的二儿子不幸离世的消息,所有人为她悲痛不已——这无疑对她造成了重创,这要是发生在其他人身上,或许早就被击垮了。然而,Frances花了一个星期处理了儿子的后事,便回到实验室继续工作。所有人都看在眼里,Frances整日红着眼睛,有时甚至情绪不稳,但她没有间断科研工作——我至今还能清晰地回忆起她忍痛含泪在办公室与我们讨论实验进展的情形。
我一直能感受到Frances对待科学的责任感和信念感,也启发着太多的后辈科学家们。她希望她发展的科学与技术能为人所有,能为人类进步有所贡献。当她看到好的科学,尤其是能为人类带来益处的科研,即使不在她所处的领域,她也不遗余力的推崇。她对科学的传承,有着很强的责任感,她的学生不管去了工业界还是学术界,她都毫无保留的支持——她坚信科学的盛世能推动人类社会的进步!她一直鼓励着年轻的学生们,不管在什么行业,去为这个世界做一点有意义的事,就算很渺小!若说这世上有什么成功的秘诀,那只有不断的努力和坚定的信念!
参考文献:
[1]Chen K, Huang X, Kan SBJ, Zhang RK, Arnold FH. Enzymatic construction of highly strained carbocycles. Science, 2018, 360, 71‒75.
[2] Kan SB, Lewis RD, Chen K, Arnold FH. Directed evolution of cytochrome c for carbon-silicon bond formation: Bringing silicon to life. Science, 2016, 354, 1048‒1051.
[3] Kan SBJ, Huang X, Gumulya Y, Chen K, Arnold FH. Genetically programmed chiral organoborane synthesis. Nature, 2017, 552, 132‒136.
[4] Chen KQ, Arnold FH. Enzyme engineering for nonaqueous solvents: random mutagenesis to enhance activity of subtilisin E in polar organic media. Biotechnology, 1991, 9, 1073‒1077.
[5] Chen K, Arnold FH. Tuning the activity of an enzyme for unusual environments: sequential random mutagenesis of subtilisin E for catalysis in dimethylformamide. PNAS, 1993, 90, 5618‒5622.
[6] Arnold FH. Engineering proteins for nonnatural environments. The FASEB journal, 1993, 7, 744‒749.
[7] Renata H, Wang JZ, Arnold FH. Expanding the Enzyme Universe: Accessing Non‐Natural Reactions by Mechanism‐Guided Directed Evolution. ACIE, 2015, 54, 3351–3367.
[8] Buller AR, Brinkmann-Chen S, Romney DK, Herger M, Murciano-Calles J, Arnold FH. Directed evolution of the tryptophan synthase β-subunit for stand-alone function recapitulates allosteric activation. PNAS, 2015, 112, 14599–14604.
[9] Romney DK, Murciano-Calles J, Wehrmuller JE, Arnold FH. Unlocking Reactivity of TrpB: A General Biocatalytic Platform for Synthesis of Tryptophan Analogues. JACS, 2017, 139, 10769–10776.
[10] Schmidt-Dannert C, Umeno D, Arnold FH. Molecular breeding of carotenoid biosynthetic pathways. Nat. Biotech., 2000, 750–753.
[11] Bastian S, Liu X, Meyerowitz JT, Snow CD, Chen MMY, Arnold FH. Engineered ketol-acid reductoisomerase and alcohol dehydrogenase enable anaerobic 2-methylpropan-1-ol production at theoretical yield in Escherichia coli. Metabolic Engineering, 2011, 13, 345–352.
[12] Glieder A, Farinas ET, Arnold FH. Laboratory evolution of a soluble, self-sufficient, highly active alkane hydroxylase. Nat. Biotech., 2002, 20, 1135–1139.
[13] Hammer SC, Kubik G, Watkins E, Huang S, Minges H, Arnold FH. Anti-Markovnikov alkene oxidation by metal-oxo–mediated enzyme catalysis. Science, 2017, 358, 215–218.
[14] Farwell CC, Zhang RK, McIntosh JA, Hyster TK, Arnold FH. Enantioselective enzyme-catalyzed aziridination enabled by active-site evolution of a cytochrome P450. ACS Cent. Sci., 2015, 1, 89–93.
[15] Coelho PS, Brustad EM, Kannan A, Arnold FH. Olefin cyclopropanation via carbene transfer catalyzed by engineered cytochrome P450 enzymes. Science, 2013, 339, 307–310.
[16] Prier CK, Zhang RK, Buller AR, Brinkmann-Chen S, Arnold FH. Enantioselective, intermolecular benzylic C-H amination catalysed by an engineered iron-haem enzyme. Nat. Chem., 2017, 9, 629–634.
[17] Savile CK, Janey JM, Mundorff EC, Moore JC, Tam S, Jarvis WR, Colbeck JC, Krebber A, Fleitz FJ, Brands J, Devine PN, Huisman GW, Hughes GJ. Biocatalytic asymmetric synthesis of chiral amines from ketones applied to sitagliptin manufacture. Science, 2010, 329, 305–309.
[18] Cobb RE, Chao R, Zhao H. Directed evolution: Past, present, and future. AIChE Journal., 2013, 59, 1432–1440.
[19] Moore JC, Arnold FH. Directed evolution of a para-nitrobenzyl esterase for aqueous-organic solvents. Nat. Biotech., 1996, 14, 458–467.
[20] Lauchli R, Rabe KS, Kalbarczyk KZ, Tata A, Heel T, Kitto RZ, Arnold FH. High-throughput screening for terpene-synthase-cyclization activity and directed evolution of a terpene synthase. Angew. Chem. Int. Ed., 2013, 52, 5571–5574.
[21] Packer MS, Liu DR. Methods for the directed evolution of proteins. Nat. Rev., 2015, 16, 379–394.
[22] Heim R, Prasher DC, Tsien RY. Wavelength mutations and posttranslational autoxidation of green fluorescent protein. PNAS, 1994, 91, 12501–12504.
[23] McIsaac RS, Arnold FH, et al. Directed evolution of a far-red fluorescent rhodopsin. PNAS, 2014, 111, 13034–13039.
[24] Santoro SW, Wang L, Herberich B, King DS, Schultz PG. An efficient system for the evolution of aminoacyl-tRNA synthetase specificity. Nat. Biotech., 2002, 20, 1044–1048.
(本文由陈凯供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号