重磅!中国大陆首张F1CDx检测报告刚刚签发!深度解密FoundationOne CDx诞生技术细节
本文获“奇点网”授权转载,版权归“奇点网”所有,任何转载需获得“奇点网”授权。
就在刚刚,FoundationOne CDx在中国大陆的首张报告新鲜出炉了,很多人都在期待的新技术终于落地。癌症患者到底如何用药,这或许就是解决的开始。

“对人类基因组的理解正在剧烈影响几乎所有的医学领域。Foundation Medicine正在利用基因组数据的力量来改善对癌症的治疗,这将是十分重要的一步。我很高兴能够成为它的支持者。”
这是2013年,在Foundation Medicine结束B轮投资之后,投资者Bill Gates在采访中说的话。整个B轮融资总额达5600万美元,投资者名单还包括谷歌风投等行业大佬。[1]

而这家被引领时代的人所选择的公司,2017年年底交出了一份接近满分的答卷——该公司的基因测序产品FoundationOne CDx被FDA批准为首个泛瘤种伴随诊断产品,324个基因、两个可以预测免疫检查点抑制剂疗效的分子标记(MSI/TMB)、覆盖全部实体瘤(除肉瘤)、直接对应FDA批准的17个靶向治疗方案!
可以说,癌症治疗正在变得更加精准、更加有效,而这一切的基础,都是我们对癌症基因组越来越深刻的理解。

勘破天机
从薛定谔抛出“生命是什么”的疑问,到人类窥见整个生命底层的奥秘,期间也不过短短几十年。
1952年,科学家首次证实,DNA就是我们心心念念已久的遗传物质;1953年,双螺旋结构被阐明;1958年,发现中心法则;1966年破解遗传密码;1977年,Sanger测序法出现。
人类有了一个近乎疯狂的想法,我们要搞清楚人类基因组的基本组成,揭开这数万个基因与生老病死之间的联系!
人类基因组计划(HGP)耗费了数十年光阴和无数资本,2001年草图的发布被认为是该计划的里程碑。

然而正所谓了解得越多,越认识到自己的无知。人类基因组计划就是生命的全部机密吗?那么疾病呢,尤其是人类第一大敌癌症呢,它们和基因组又是什么样的关系呢?癌症基因组图谱(TCGA)紧接着启动了。
这两项庞大的计划,做的是以人力破解“天机”的工作,这期间涌现了无数优秀的科学家,带动了测序技术的蓬勃发展,同时也带动整个生物医学行业进入了分子时代。我们对癌症的认知从组织病理学转向分子层面,大批研究者开始尝试从基因角度去研究癌症、攻克癌症。
可以预见的未来里,市场将会出现大量针对癌症相关基因突变的靶向药物,那么相应的,我们也要有检测基因突变的有力手段。癌症相关的突变那么多,难道一个一个挨着检测过去吗?
星火
癌症基因图谱项目中,主要参与的有三个顶级科研机构,其中之一就是Broad研究所。正是出身于这里的几位顶级科学家解决了上述的难题。
Matthew Meyerson是TCGA的首席研究员,主管肺癌项目,他的同事Levi Garraway则是黑色素瘤/头颈癌项目的主管。这两位作为癌症基因组学的领军人物,早早意识到了精准治疗的市场前景。2006年,他俩就合作过一篇论文,尝试通过焦磷酸测序技术对肿瘤组织中的238个肿瘤相关基因进行大规模平行测序[2]。

左:Meyerson 右:Garraway
好了,回到Meyerson和Garraway。完成研究之后,他俩就意识到,对癌症的大规模测序绝对是未来的“刚需”,这个技术应该继续发展并且推广出去。不过那会儿基因测序还是一项十分昂贵的技术,如果不是人人都用得起,那也没什么意义,到底怎么把技术落地还得商榷一下。
于是两人决定找个人商量下。这个人就是Broad研究所的所长Eric Lander。
Lander也是位真业界大牛,他是人类基因组计划的重要领导者,2001年发布的基因组草图他就是第一作者[3]。巧的是,他也很早就意识到了基因组学对癌症研究的意义。1993年,他曾经牵头成立过一家基因公司Millennium Pharmaceuticals,尝试进行癌症基因组学研究。不过很可惜的是,思维虽已走得很远,技术却跟不上,Lander最初的努力失败了。

Eric Lander
不过这时已是2007年,正是454、Hiseq、Solid等下一代测序仪全面开花的时候,以我们后来人的角度看,真是没有再好的时机了。
Millennium Pharmaceuticals公司当年还健在的时候,CEO是位叫做Mark Levin的科学家。他离开MP之后成了一名投资人,就职于投资了诸多生物技术企业的Third Rock Ventures。他对Lander们的想法也很感兴趣,不过毕竟经历过一次失败,也了解市场的行情,深知基因诊断业务开展之艰难,对此还是比较谨慎。
接下来的两年多时间里,开荒者们找到了许多科学家、肿瘤学家、临床研究者、律师甚至保险行业从业者,商讨商业战略。Garraway曾笑称,像是在“定制新时代商业诊断的全套流程”。当然了,这也是没有办法的,毕竟这事儿根本没有先例可参考。
2010年,Third Rock Ventures注资成立了Foundation Medicine Inc(FMI),并派来了深知生物技术企业运营的Alexis Borisy。而Lander、Meyerson、Garraway,还有Todd Golub——将DNA微阵列等基因组工具带入癌症研究的先驱——这四人作为创始顾问,天时地利人和,FMI终于开始了它的航行。[4]

Todd Golub
两年后,2012年,FMI推出了第一款诊断产品FoundationOne,能够对临床肿瘤样本进行高精度、大规模平行测序,检测包括点突变、缺失插入、基因拷贝变化等关键突变类型,并且涵盖了常见的临床治疗/研究靶点。
技术终于赶上了时代。
跬步
FMI能够健康发展,回头看看Millennium Pharmaceuticals公司的失败,只能感慨这是一滴时代的眼泪。
1977年,Sanger发明了第一代测序技术,让人类有了一窥“上帝密码本”的能力。尽管这项技术统治了科研界30年,但由于测序周期长、成本高,这项技术很难适应需要大规模测序的临床应用。
2005年,第二代测序技术(下一代测序,NGS)的商业化,把人类全基因组测序的时间从三年,缩短到一个礼拜!
仅一年后,Meyrson和Garraway就打算用这项技术造福癌症患者了。2006年他们发表在《自然医学》杂志上的论文就显示[2],二代测序技术能够有效地检出突变频率低到0.2%的变异。更厉害的是,即使是福尔马林固定、石蜡包埋(FFPE)的组织样它也能准确地检测,可见是更加适应临床需求的。

2011年,经过几轮升级的新测序平台发表在了《癌症研究》上[5]。新技术对137个基因的2732个外显子进行了捕获,平均测序深度能够达到400倍。
值得称道的是,这次研究者们的目光直接对准了临床,靶向的基因涵盖了FDA已批准的药物靶点、正在进行临床试验的靶点、与预后或耐药性相关的靶点、用于诊断的靶点,以及更多暂时“意义不明”的癌症相关突变。
特别值得一提的是10个FFPE样本中,有两个肿瘤样本纯度只10-20%,也成功检测到了KRAS、PIK3CA、MSH2等具有重要临床意义的基因突变。研究者还与一种质谱法检测平台OncoMap做了对比。在新技术检出的所有的样本突变中,OncoMap理论上可以检出13种,不过实际上只检出了10种。
以这项技术为基础,很快,FoundationOne诞生了。

千里
技术会停下脚步吗?永远不会!
从科研走向临床,技术面临的困难远比我们想象得要多。临床上肿瘤组织一般是FFPE切片样本或者是穿刺取样,前者会对DNA造成损伤,后者样本量有限;还有另一个问题,临床上实际操作中难以精准定位肿瘤组织,这对检测方法的灵敏性和特异性提出更高要求,毕竟患者可是容不得试错的;在样本有限的情况下,技术要实现对数百万个碱基的检测,这样大的数据,需要更加系统和严格的验证。
临床上评估癌症基因,常用Sanger测序、质谱基因分型技术、荧光原位杂交技术(FISH)、免疫组化分析(IHC)等技术。不过还是那句话,考虑到技术和样本的限制,它们哪个都满足不了大规模的基因检测的要求。
到底还是得看NGS的!2013年,FMI核心技术登上Nature Biotechnology[6],这个版本能够检测到基因点突变、插入缺失、拷贝数变化和基因重排,覆盖287个癌症相关基因,敏感性95-99%,特异性99%,而且与其他所有临床手段对比,均有95%以上的一致性!在对2221例临床病例检查中,76%的患者检测出了至少一个具有临床意义的靶点,这些突变位点对于患者的治疗、诊断和预后具有重要的价值!

为了测试技术到底多强,研究者通过将胚系点突变已知的多个正常细胞系,体细胞插入缺失突变已知的多个肿瘤细胞,以及拷贝数已知的肿瘤细胞和其对应的正常细胞分别按照不同的比例进行混合,在不同等位基因突变频率(MAF)条件下评估点突变,插入缺失和拷贝数变异的检测性能。
在对点突变的检测中,中位测序深度达到了738倍,99%以上的外显子区域测序深度都达到了250倍。对于MAF≥10%的位点,敏感性>99%(1036/1036);MAF<10%的位点也达到了99%(1013/1021)。那些没有检出的位点,都是MAF在5%以下的。
在检测插入缺失上,数据同样喜人,中位测序深度达667倍,对MAF≥20%的位点,敏感性98%(92/94);MAF在10-20%之间的,敏感性97%(71/73);MAF在5-10%之间的,敏感性也有88%。
对拷贝数变化的检测则受限于样本的纯度和拷贝数变化的数量。对纯度在30%以上、拷贝数变化大于8的样本,敏感性也达到了99%(91/92)。
在这三项检测中,整体的阳性预测值(PPV)都在99%以上。
那么和其他技术对比一下,孰优孰劣呢?研究者就NGS和质谱基因分型、FISH、IHC四项技术,在249个FFPE样本中进行了盲测。
首先,在检测碱基替换和插入删除上,质谱基因分型技术略输了一筹。质谱基因分型技术共检测到101个突变,其中97个突变NGS也检测到了,而且NGS还另外检测到了7个突变,也就是共检测到104个突变,比质谱基因分型技术要更多。在检测结果一致的位点中,有超过25%以上的位点MAF≤10%,可见在临床癌症基因检测中高敏感性的必要性。
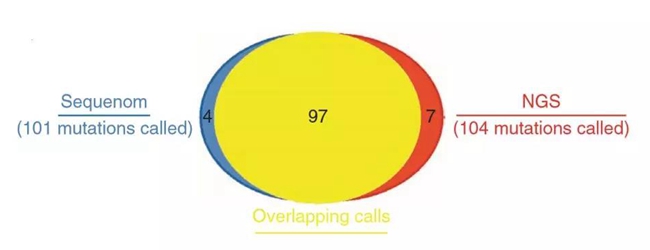
NGS显然比质谱基因分型略胜一筹
在检测拷贝数变化上,NGS也表现优异,与IHC、FISH一致性保持在95%-100%!
用在临床病例上就更不用说了,对2221名患者的组织样本进行检测,95.1%(2112/2221)患者检出突变,测序深度达到1134倍,平均每个样本具有3.06个突变。就算只看那些具有临床意义的突变,每个样本也有1.57个,有76%的患者至少有一个有临床意义的突变。
就拿著名靶点HER2突变来说吧,虽然目前FDA只在乳腺癌和食管癌上批准了相应的治疗方案,但是实际上在其他的12种癌症中也都检出了HER2突变,占总病例的5%。而且这些HER2突变病例中,有40%属于点突变或者插入删除,这种情况用传统的生物标记物检测方法,如FISH/IHC是根本检测不到的。
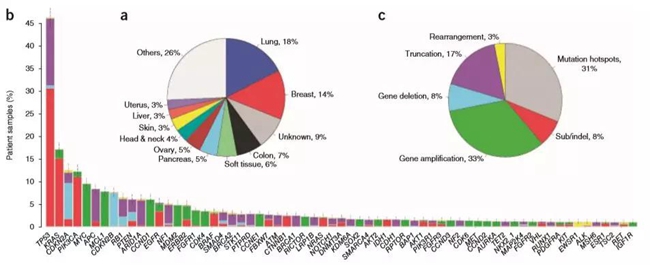
NGS能够做到覆盖大量基因和不同癌种
新启航
正如前文所说,技术永远不会停下脚步,在精准医疗上尤其如此。技术的完善只是起点,背后庞大的数据、海量的病例支持才是它能够获得广泛应用的坚实后盾。
十数年的发展中,FoundationOne CDx作为研究工具协助无数科研成果的发现,在这个过程里也积累了大量的数据。FMI独有的数据库FoundationCore是目前世界上最大的癌症基因组数据库之一,拥有超过18万患者的数据记录;FMI也与50家以上的生物制药企业合作,帮助加速新的靶向药物研发,科研成果汇总成340多篇科研论文。
在这些数据的基础上,FoundationOne CDx能够覆盖到全部实体瘤、324个重要基因,特别是针对非小细胞肺癌、黑色素瘤、乳腺癌、结直肠癌、卵巢癌五大癌种,17中FDA批准的靶向疗法中,12种是指南推荐的一线疗法。
除此之外,FoundationOne CDx还可以计算微卫星稳定性(MSI)和肿瘤突变负荷(TMB)两种分子标记,可以作为癌症治疗、特别是免疫治疗的参考。
想必以上这些数字还会随着科研和临床的进展不断更新,随着时代的进步,我们手中掌握的武器会越来越强大。

未来
在最早尝试利用基因组数据打败癌症的先行者里,乔布斯当是最有名的一个。他生前曾花费十万美元来剖析自己的基因组,尝试与癌症基因相应的治疗方案。遗憾的是,当时尚未成型的技术没能挽救这个走得太快的灵魂。
如今,诊疗技术愈发成熟,经济成本日渐降低;谷歌等互联网公司的参与,将数据从实验室搬到移动设备,让高端技术变得触手可及。
可喜的消息是,今年8月起,FoundationOne®CDx经历了技术转移、实验室准备、临床样本验证和生信团队培训等一系列工作后,终于可以在国内大展身手了,现在中国患者也能够使用上最新的技术。
或许真的如同乔布斯所说的那样,“如果我不是第一批因精准医疗治愈癌症的人,那么我也应当是最后一批在精准医疗时代死于癌症的人。”[7]
未来尚且大有可期。
参考资料:
[2]Thomas R K, Nickerson E, Simons J F, et al. Sensitive mutation detection in heterogeneous cancer specimens by massively parallel picoliter reactor sequencing[J]. Nature medicine, 2006, 12(7): 852.
[3]https://en.wikipedia.org/wiki/Human_Genome_Project
[5]Wagle N, Berger M F, Davis M J, et al. High-throughput detection of actionable genomic alterations in clinical tumor samples by targeted, massively parallel sequencing[J]. Cancer discovery, 2011: CD-11-0184.
[6]Frampton G M, Fichtenholtz A, Otto G A, et al. Development and validation of a clinical cancer genomic profiling test based on massively parallel DNA sequencing[J]. Nature biotechnology, 2013, 31(11): 1023.
[7]https://www.technologyreview.com/s/519686/steve-jobs-left-a-legacy-on-personalized-medicine/
[8]https://www.technologyreview.com/s/426987/foundation-medicine-personalizing-cancer-drugs/
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号