可见光驱动下利用甲苯类化合物和烯酮一锅法合成萘衍生物
萘的衍生物是很多重要药物分子的结构单元,大部分复杂分子中萘的结构单元都是由不同取代的萘前体来间接合成的,由简单易得的原料来直接合成萘环的报道很少。目前的策略主要基于苯的衍生物的环化和环加成反应。因此,发展一种新型的萘环合成方法具有重要的合成意义。
近年来,可见光参与的催化反应取得了非常迅速的发展,人们利用光催化剂和可见光实现了多种有合成应用价值的转化。最近,新加坡国立大学化学系的吴杰博士课题组和北京师范大学的陈雪波教授和方维海教授课题组合作,发展了将可见光催化剂和路易斯酸催化剂结合,从简单的甲苯类化合物C(sp3)-H活化,一锅法合成多取代萘环化合物的反应(图1)。

图1. 苄基共轭加成反应
该课题组先前的研究发现,苄基C-H键能够被光催化剂Acr-Mes-ClO4的激发态氧化成苄基自由基,然后加成到双氰基的缺电子烯烃上。但是该反应的底物非常局限,当底物为一般的烯酮时,反应不能发生。通过优化,该课题组发现加入10%的路易斯酸Cu(OTf)2能够显著提高反应的产率,而且底物具有很好的官能团兼容性(图2)。

图2. 可见光驱动1,4-共轭自由基加成反应的底物适用范围
提高反应的温度,作者能够检测到少量的萘环产物。通过优化,作者发现结合路易斯酸催化剂和氧气,1,4-加成产物能够转化为多取代的萘环产物(图3)。其中路易斯酸Cu(OTf)2和氧气是十分必要的,不加入路易斯酸时,反应会受到抑制;不加入氧化剂时,反应会得到歧化产物四氢萘。
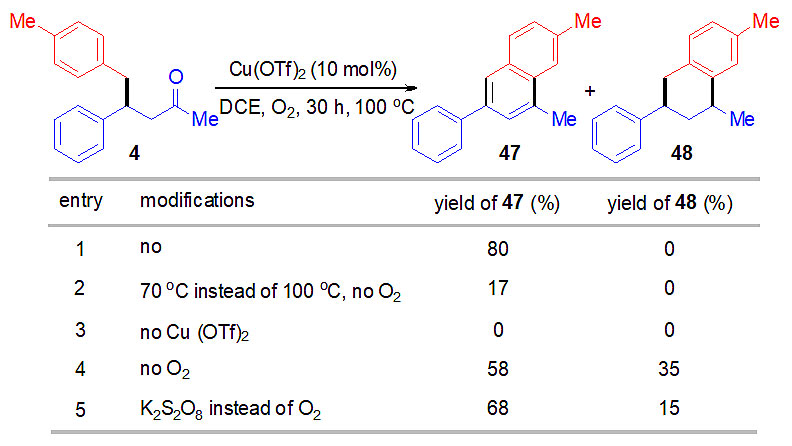
图3. 路易斯酸促进的Fridel-Crafts羟烷基化/氧化芳构化反应
作者将1,4-自由基加成反应和Fridel-Crafts羟烷基化/氧化芳构化反应结合起来,实现了从甲苯类似物和烯酮出发,一锅法合成多取代萘环产物(图4)。
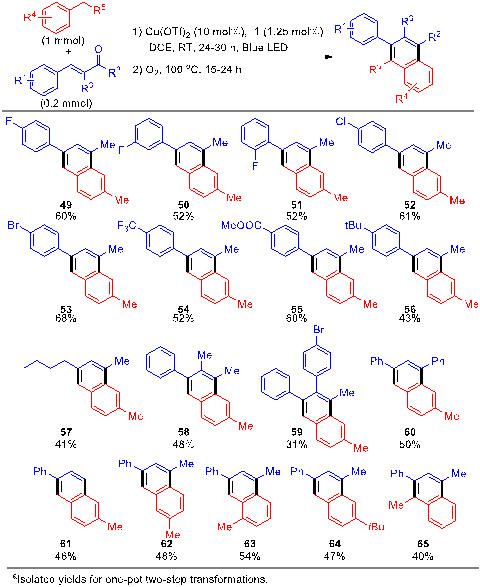
图4. 一锅法合成多取代萘的底物适用范围
1,4-加成反应的机理研究表明,该反应能被TEMPO抑制,同时在光催化剂的激发态下,荧光会被二甲苯定量淬灭,由此证明了苄基自由基的形成机理。同时,烯酮底物的还原电势与催化剂的还原电势不匹配,否定了从烯酮还原开始启动催化循环的假设。具体的催化循环见图5。
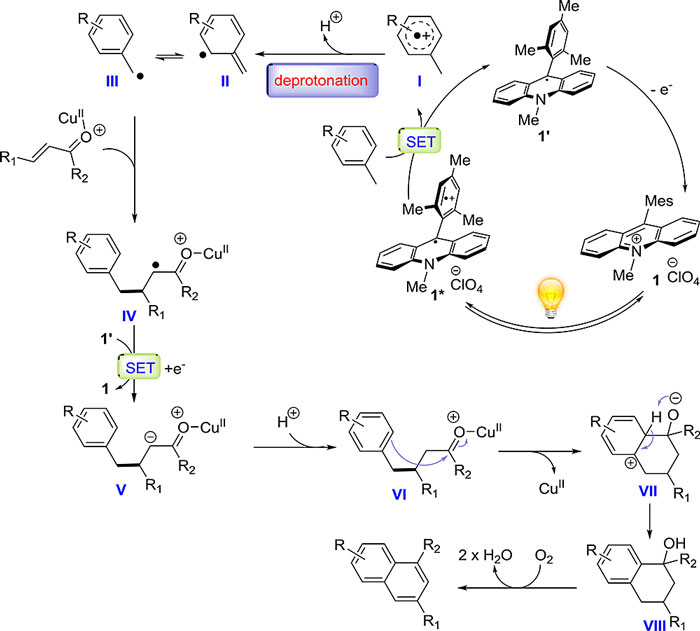
图5. 一锅法合成多取代萘环的反应机理
该催化体系通过可见光催化剂和路易斯酸催化剂的协同作用实现了一种方便、快捷的合成γ-芳基酮的反应。同时,人们可以简单的甲苯类底物和烯酮作为原料,一锅法合成不同取代的萘环产物。路易斯酸Cu(OTf)2在反应中起到了双重作用。该反应具有原子经济、原料易得、合成步骤经济等优点。相关成果发表在ACS Catalysis 上,新加坡国立大学的博士刘海望为该论文的第一作者。
该论文作者为:Haiwang Liu, Lishuang Ma, Rong Zhou, Xuebo Chen, Weihai Fang and Jie Wu
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

One-Pot Photomediated Giese Reaction/Friedel–Crafts Hydroxyalkylation/Oxidative Aromatization To Access Naphthalene Derivatives from Toluenes and Enones
ACS Catal., 2018, 8, 6224, DOI: 10.1021/acscatal.8b00481
导师介绍
吴杰
http://www.x-mol.com/university/faculty/49776
方维海
http://www.x-mol.com/university/faculty/37835
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号