烯烃的立体选择性双芳基化反应
多芳基乙烷类骨架是天然产物和药物分子中极其重要的骨架结构,利用过渡金属催化烯烃的双芳基化反应构建此类骨架结构是目前重要的研究领域。但是,对反应机理进行推测便会发现,反应历程中存在着Mizoroki-Heck反应和直接交叉偶联反应这两类竞争反应,想要实现烯烃的双芳基化反应,必须抑制或者减弱这两类反应的竞争(图1)。
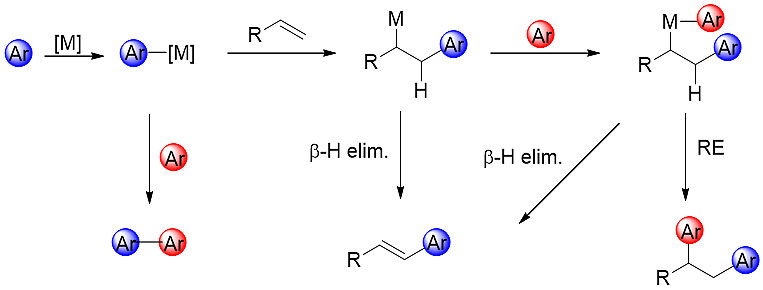
图1. 过渡金属催化芳基烯烃芳基化双官能团化反应的机理研究
Catellani等科学家在90世纪利用降冰片烯类底物的刚性特性,使得β-碳上的氢原子不易发生消除反应,进而实现环状内烯烃的双芳基化 (Tetrahedron, 1989, 45, 5263; Synthesis, 1998, 1998, 1249)。随着过渡金属催化交叉偶联反应的发展,Sigman教授在2009年利用钯催化体系实现了苯乙烯的双芳基化反应,但芳基源局限于芳基锡试剂,而且引入的是两种结构相同的芳基基团(Angew. Chem. Int. Ed., 2009, 48, 3146)。随后该课题组成功利用1,3-共轭二烯作为反应底物,实现了末端共轭烯烃的1,2-杂双芳基化反应 (Org. Lett., 2014, 16, 4666)。该反应成功的关键在于镍插入烯烃后生成了更加稳定的烯丙基镍中间体,从而使转金属化和还原消除反应顺利发生。宋秋玲教授采用萘环的共轭效应来稳定π-芳基苄-钯中间体的策略,实现了萘乙烯类底物的双芳基化反应,文中提到苯乙烯类底物在该体系中不适用,主要产物是Heck产物和Suzuki偶联产物 (Org. Chem. Front., 2017, 4, 1224)。因此,如何实现结构简单的苯乙烯类底物的双芳基化反应成为目前的研究热点。Giri课题组通过在苯乙烯邻位引入亚胺作为导向基团,在镍催化下实现了末端烯烃的双芳基化反应,利用芳基锌试剂作为亲核试剂,芳基卤化物作为亲电试剂,在文中明确提出亚胺基团不可或缺,没有导向基团只有部分交叉偶联产物和Heck消除的产物生成 (J. Am. Chem. Soc., 2017, 139, 10653)。然而作者推测能否对亲核试剂及亲电试剂的结构类型进行调控,实现首例镍催化无导向基团参与芳基烯烃的杂双芳基化反应。
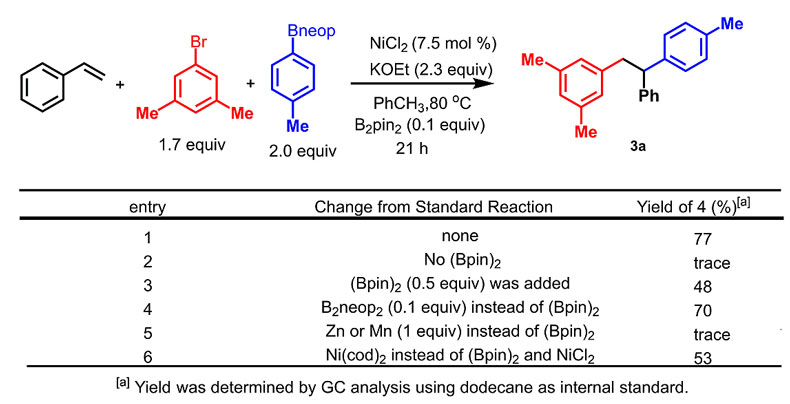
图2. 条件优化
通过筛选一系列的镍催化剂、芳基卤化物、芳基硼酸衍生物、碱、溶剂等反应因素,作者发现利用二氯化镍和联硼酸频那醇酯((BPin)2)的混合催化体系,溴苯作为亲电试剂,芳基硼酸酯作为亲核试剂,甲苯作为反应溶剂,在80 ℃下成功地实现了苯乙烯类底物的1,2-双芳基化反应。在此条件下,三芳基乙烷的产率可以达到77%,也会有少量交叉偶联产物生成。该反应成功的关键是发现了催化量的联硼酸频那醇酯((BPin)2)和乙醇钾能将二氯化镍还原成零价镍,虽然使用零价镍(Ni(cod)2)只能得到收率中等的产物,但是证实该反应的催化循环是从零价镍启动的。
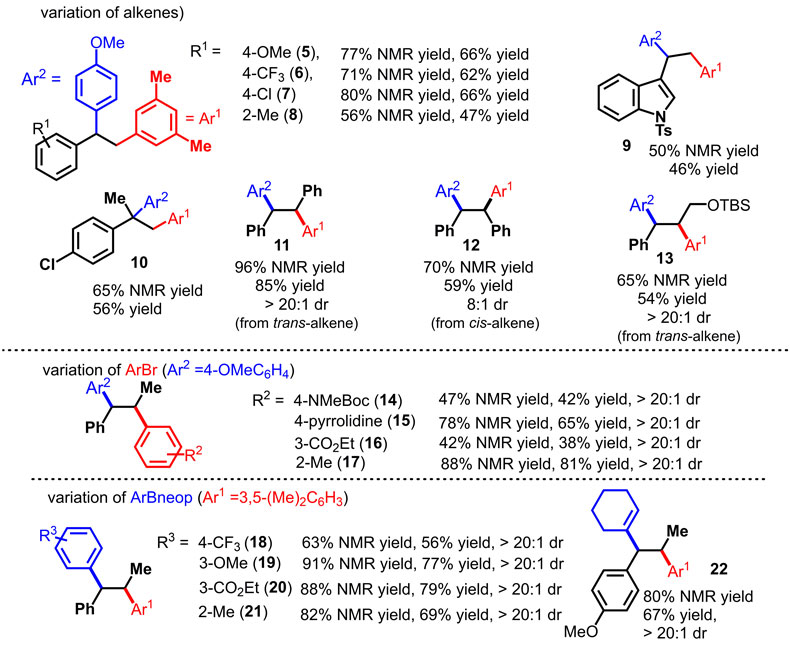
图3. 双芳基化反应的底物拓展
随后作者考察了反应底物的普适性,苯环无论修饰吸电子的三氟甲基、氯原子还是给电子的甲氧基,或邻位修饰取代基,反应都能以较高的收率转化成目标产物。值得一提的是,各种β-取代的苯乙烯都可以顺利转化,且产物全部以顺式加成为主,非对映选择性的比例普遍高于20:1,如反式1,2-二苯乙烯和顺式1,2-二苯乙烯都能转化成非对映异构的四芳基乙烷11和12,但顺式二苯乙烯产物的非对映选择性比例略低。芳基溴苯和芳基硼酸酯无论修饰吸电子还是给电子的取代基,都能以较高的收率转化成目标产物,非对映选择性均大于20:1。环己烯基硼酸酯作为底物也可以实现芳基烯基化反应(22)。
另外,该策略还可成功地用于消旋拉索昔芬(lasofoxifene)药物分子前驱体的合成。
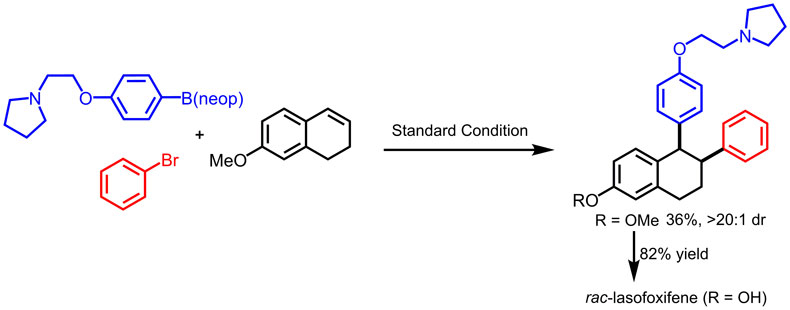
图4. 消旋拉索昔芬(lasofoxifene)药物分子前驱体的制备
总结
作者发展了一种新颖、独特的芳香烯烃的双芳基化反应,反应的普适性很好,首次实现了双取代芳基内烯烃的双芳基化反应,且非对映选择性好。该方法为多芳基乙烷骨架的构建提供了高效、新颖的策略。
相关工作在J. Am. Chem. Soc.在线发表,西安交通大学理学院的高品博士为论文的第一作者(Pin Gao,博士毕业于兰州大学,师从梁永民教授,现与张志成课题组、段新华课题组进行合作研究;2017年9月-2018年9月在美国印第安纳大学布鲁明顿分校Kevin Brown课题组从事访问学者研究),共同第一作者为Brown课题组的博士后陈良安(Liang-An Chen,博士毕业于厦门大学,导师Eric Meggers教授)。印第安纳大学的Kevin Brown教授为该论文的通讯作者,西安交通大学为第一署名单位。该工作得到国家自然科学基金、国家留学基金委等项目的支持。
该论文作者为:Pin Gao, Liang-An Chen and M. Kevin Brown
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Nickel-Catalyzed Stereoselective Diarylation of Alkenylarenes
J. Am. Chem. Soc., 2018, 140, 10653, DOI: 10.1021/jacs.8b05680
导师介绍
Kevin Brown
http://www.x-mol.com/university/faculty/1158
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号