Phil Baran携手BMS的Science巨作:颠覆性合成新方法,推动小核酸制药技术革命
副标题:精准操控硫代磷酸立体化学,促进高立体纯反义寡核苷酸的合成
近日,美国斯克利普斯研究所(the Scripps Research Institute,TSRI)的合成化学家Phil Baran教授与制药巨头百时美施贵宝(Bristol-Myers Squibb,BMS)的Martin Eastgate、Michael Schmidt等研发者合作完成了一项壮举,他们开发了一种可扩展的基于PSI(phosphorus-sulfur incorporation)试剂的方法,可以精准调控硫代磷酸的立体化学结构,从而促进高立体纯度反义硫代磷酸寡核苷酸药物的合成。这一里程碑式的成果有望给小核酸制药行业带来翻天覆地的变化。相关报道发表在近期的Science 杂志上。
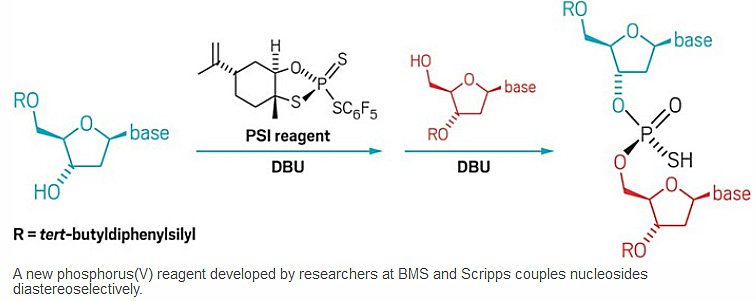
图1. 基于PSI试剂制备高立体纯反义硫代磷酸寡核苷酸。图片来源:C&EN[1]
作为继小分子药物、蛋白药物之后的第三大新药类型,小核酸药物正推动着制药领域的第三次产业革命。在小核酸药物家族的诸多成员中,反义寡核苷酸(antisense oligonucleotide, ASO)药物无疑是最引人关注的代表。截至2017年1月 [2],美国FDA已批准上市的6个小核酸药物中,有4个是反义寡核苷酸药物,其中反义硫代磷酸寡核苷酸又占据了3个席位,分别是1998年批准的Vitravene(Fomivirsen)、2013年批准的Kynamro(Mipomersen)以及2016年批准的Spinraza(Nusinersen)。同时,目前仍有大批反义硫代磷酸寡核苷酸药物处于不同阶段的临床研究中。

图2. 反义硫代磷酸寡核苷酸药物Vitravene(Fomivirsen)。图片来源:Wikipedia
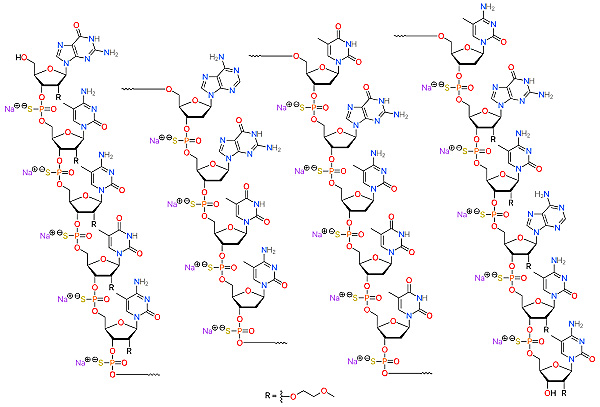
图3. 反义硫代磷酸寡核苷酸药物Kynamro (Mipomersen)。图片来源:Wikipedia
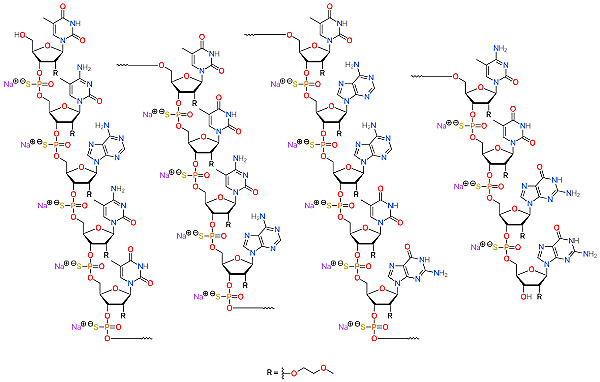
图4. 反义硫代磷酸寡核苷酸药物Spinraza (Nusinersen)。图片来源:Wikipedia
反义硫代磷酸寡核苷酸
反义寡核苷酸药物是指与靶基因DNA或mRNA特定序列互补的寡核苷酸分子,主要根据碱基互补配对原则和核酸杂交原理,从基因复制、转录、剪接、翻译等水平上调节靶基因的表达,干扰遗传信息从核酸向蛋白质的传递,从而达到抑制、封闭或破坏靶基因的目的。简单点说,可以把反义寡核苷酸药物看作靶标基因的“抑制剂”。反义寡核苷酸药物一般由十几到几十个核苷(脱氧核糖核苷或核糖核苷)通过3',5'-磷酸二酯键连接而成,即寡核苷酸上相邻两个核苷五碳糖的3'位羟基与5'位羟基通过一分子磷酸桥连。一般情况下,未经修饰的反义寡核苷酸被细胞吸收的效率较低,且容易被细胞内普遍存在的核酸酶降解,为了克服这两个缺点、提高成药性,科学家对其骨架(磷酸基、糖基、碱基)进行了不同的化学修饰,迄今研究最深入、应用最广泛的方法则是使用S原子取代磷酸基团上未与糖环成键的O原子,得到更稳定更易摄取的反义硫代磷酸寡核苷酸。但是,S原子的引入也为药物化学家们带来了另一个大麻烦——合成。
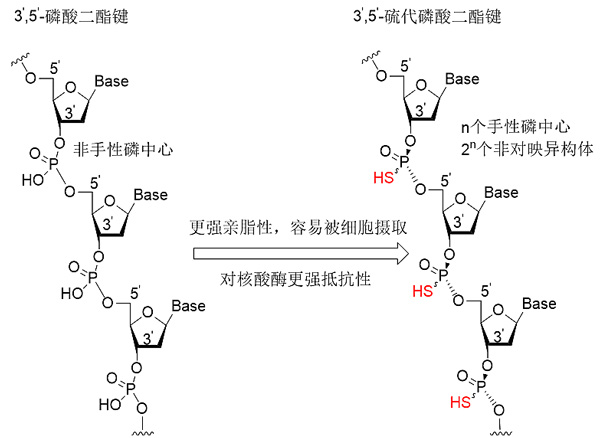
图5. 反义寡核苷酸 vs. 反义硫代磷酸寡核苷酸
立体纯异构体合成是难题
众所周知,含有手性中心的药物分子在进入生命体后,不同的立体异构体往往会表现出截然不同的生理活性和毒性——某一个异构体是有效的,而其他异构体可能是无效甚至有害的。因此,使用立体纯的药物不仅可以排除无效、不良异构体所引起的毒副作用,还能减少药剂量以及人体对无效、不良异构体的代谢负担,提高药物的专一性。
令人遗憾地是,当前几乎所有在研和上市的反义硫代磷酸寡核苷酸药物都是以异构体混合物的形式出现,其原因在于硫代磷酸基立体化学的不可控性。以2016年FDA批准上市的重磅反义寡核苷酸药物Spinraza(Nusinersen)为例,17个具有手性的硫代磷酸基理论上使其可以产生131072(217)个立体异构体。换言之,如今接受Spinraza治疗的患者可能正在使用一种含10万多种立体异构体的药物,而其中的大多数可能是无效甚至有害的。
因此,如何制造出成千上万个立体特异性的硫代磷酸寡核苷酸,并从中筛选治疗效果最佳的药物,是小核酸制药领域仍未解决的最大难题之一。
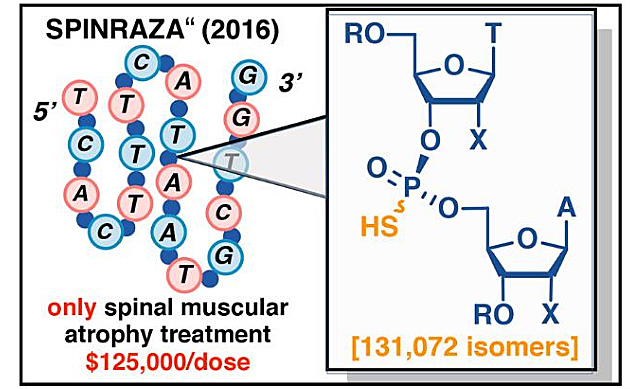
图6. Spinraza拥有数以十万计的立体异构体。图片来源:Science
来自学术界的挑战
目前,学术界已有一些关于控制硫代磷酸寡核苷酸(简称为“PS-寡核苷酸”)立体化学的研究报道,其策略主要是使用手性P(III)试剂形成P-核苷单体砌块进行迭代反应。
P(III)-核苷单体砌块法
Wada教授等人使用手性P(III)试剂与一分子核苷3'位羟基发生取代反应形成P(III)-核苷单体1,然后通过立体专一的SN2反应将1接入母体核苷2的5'位羟基形成P(III)桥连的二核苷酸,再经立体专一性的氧化硫化得到硫代磷酸二核苷酸,随后对链末端5'位羟基脱保护后再与1进行下一次的迭代偶联反应(SN2-氧化硫化-脱保护-SN2-氧化硫化-脱保护……)(图7)。
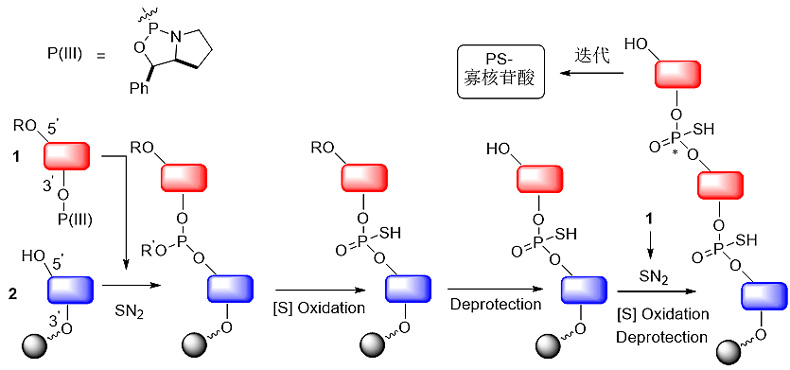
图7. P(III)-核苷单体砌块法。
P(V)S-核苷单体砌块法
Stec教授等人则是从手性P(III)出发合成P(III)-核苷单体1,接着利用立体专一的氧化硫化直接将1转化为P(V)S-核苷单体3,3与母体核苷5'位羟基进行SN2反应形成硫代磷酸二核苷酸,然后对链末端5'位羟基脱保护,与3进行下一次迭代偶联反应(SN2-脱保护-SN2-脱保护-…….)(图8)。
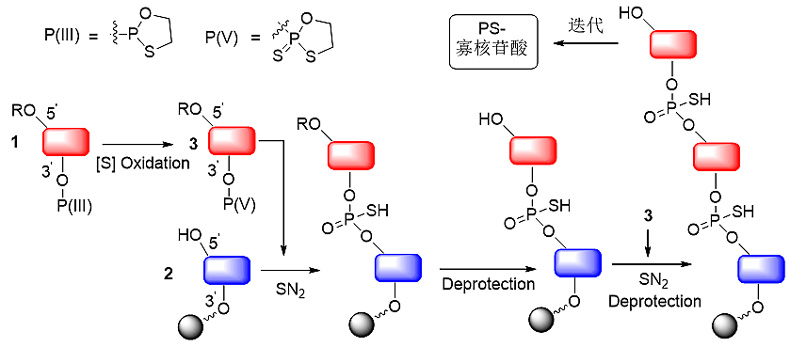
图8. P(V)S-核苷单体砌块法。
然而,以上两种方法所使用的初始手性P(III)试剂既不稳定也不易制备,加上反应中存在一些其他的弊端,导致目前这些策略还无法应用于工业化生产。
Baran教授成功解锁P(V)试剂
受Stec教授预先将硫引入核苷砌块的启发,Phil Baran教授等人决定摒弃传统上基于P(III)试剂的合成路线,设想直接从手性P(V)S-试剂(PSI reagent)出发合成P(V)S-核苷单体,然后再进行迭代偶联反应(图9)。
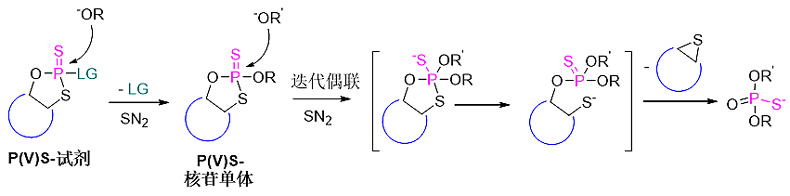
图9. 从P(V)S-试剂合成P(V)S-核苷单体。
经过大量的筛选,研究人员最终找到了最佳的手性P(V)S-试剂1——廉价、稳定、可大规模合成、精准控制磷手性(图10D)。从不同硫代磷酸基构型的P(V)S-试剂1出发,他们合成了具有不同磷手性中心的P(V)S-核苷单体,该分子与另一分子核苷发生SN2反应,可以高产率、高立体专一性地合成一系列不同碱基取代的硫代磷酸二核苷酸(图11)。
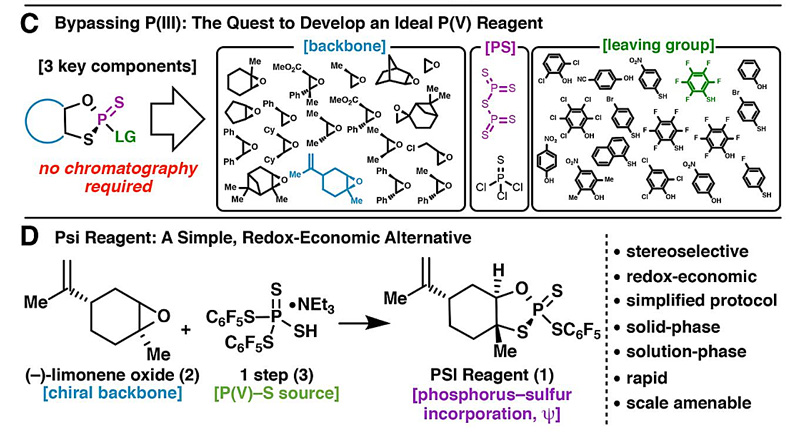
图10. P(V)S-试剂1的合成。图片来源:Science
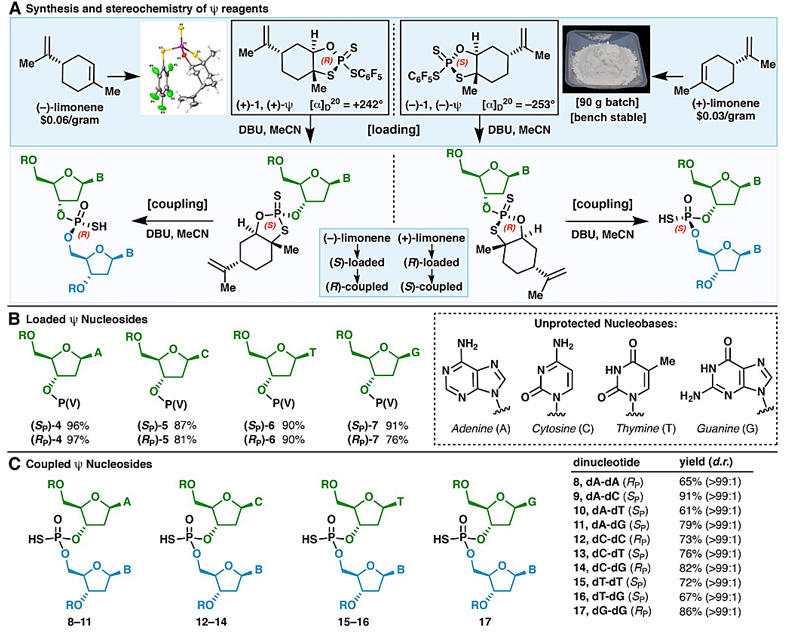
图11. 硫代磷酸二核苷酸的合成。图片来源:Science
此外,利用P(V)S-试剂1,他们还立体专一地合成了不同磷构型的硫代磷酸环二核苷酸(图12)以及Spinraza类似物——全Rp构型的硫代磷酸寡(十六聚)核苷酸(图13)。
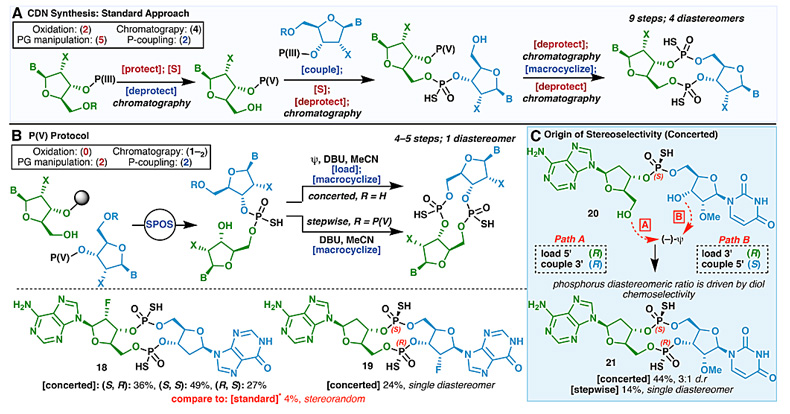
图12. 硫代磷酸环二核苷酸的合成。图片来源:Science
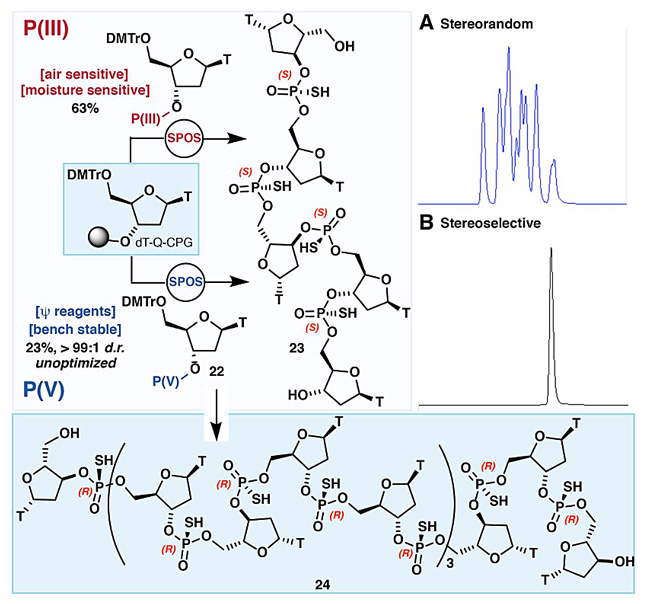
图13. 全Rp-硫代磷酸寡核苷酸。图片来源:Science
谈到这项工作,苏黎世联邦理工大学的Jonathan Hall教授赞赏不已:“能够在极具挑战性和重要性的核苷酸化学领域看到如此之新的发展,简直让人振奋不已”,他补充道,“如果这一方法可以最终扩展到其他药物相关的寡核苷酸衍生物,那么将会让整个寡核苷酸疗法产生翻天覆地的变化。”[1] “只要你有核苷酸,都可以用这种方法将它们连在一起,这真是太美妙了。”加州大学圣地亚哥分校生物学家Steven Dowdy教授说道,“它为解决现存问题提供了一个非常棒的选择”。[3]
全球核酸制药巨头Ionis公司研发部负责人Frank Bennett表示:“控制磷硫手性在寡核苷酸药物治疗中的重要性尚不清楚,而现在这些潜在的新方法可以帮助我们一探究竟。”[4]
“基于硫代磷酸酯的核苷酸化合物具有显著的治疗潜力,但人们对其理解却停滞在药物合成过程中不易控制的硫代磷酸酯立体化学上”,Phil Baran教授说道,“PSI试剂提供了一种高效、立体可控的寡核苷酸药物合成的方法,使我们能够快速创建、分析和制备候选药物的立体异构体,而这一切用现行的方法难以做到”。[5]
“环二核苷酸在激活免疫系统对抗癌症方面展现出令人难以置信的效果,但迄今为止还没有简单的方法来控制它们的立体化学,”文章第一作者Kyle Knouse说道,“毫无疑问,PSI有效、廉价地合成纯立体异构体的能力将为推进环二核苷酸抗癌的相关研究提供有力的工具。”[5]
BMS化学和合成开发部的负责人Martin Eastgate则表示,“PSI试剂具有立体选择性、简单性、稳定性,可规模化生产……为BMS提供了一个全新的合成平台,它将在未来取得怎样的成就,让我们拭目以待。”[4-5]
BMS和Scripps研究所表示,他们已经将PSI试剂授权给MilliporeSigma公司进行商业化的生产。[1]
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Unlocking P(V): Reagents for chiral phosphorothioate synthesis
Science, 2018, DOI: 10.1126/science.aau3369
导师介绍
Phil Baran
http://www.x-mol.com/university/faculty/668
参考内容:
1.https://cen.acs.org/synthesis/catalysis/Nucleotide-construction-new-chiral-tool/96/i32
2. FDA-Approved Oligonucleotide Therapies in 2017. Molecular Therapy, 2017, 25, 1069, DOI: 10.1016/j.ymthe.2017.03.023
5.https://www.scripps.edu/news-and-events/press-room/2018/20180806-baran-chemistry-bms.html
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号