Ni-Al双金属催化咪唑环的选择性C-H键环化
β位手性的双环或多环咪唑类骨架在生物活性分子中广泛存在,并作为高效的有机分子催化剂广泛应用于不对称催化领域。然而由于存在β位的取代基,构建此位点的位阻相对较大,手性控制也较为困难。现有的合成方法可通过手性原料转化实现,或者通过手性拆分获得,直接的不对称催化方法还没有成功的先例。2001年,加州大学伯克利分校的Bergman和Ellman团队使用过渡金属催化咪唑环C-H键环化的方法,首次实现了这类化合物的高效合成。但是由于反应条件过于剧烈(20 mol%的贵金属Rh和180 ℃的高温),一直无法实现其β位的立体控制。
南开大学元素有机国家重点实验室的叶萌春(点击查看介绍)研究团队致力于发展双金属协同催化的策略来实现一些较为挑战性的反应,特别是单金属中心无法有效催化的反应。近日,他们利用发展的手性二级膦氧配体锚定的Ni-Al双金属催化体系,成功实现了这一反应的立体控制。
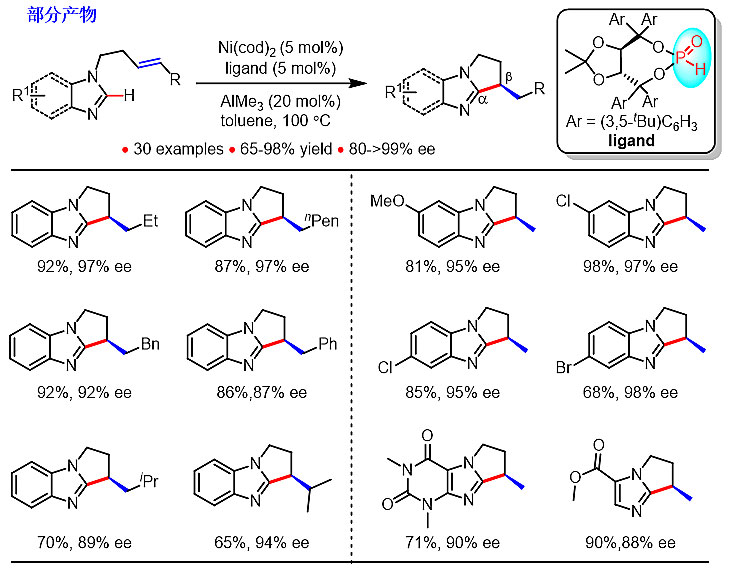
他们发现在双金属Ni(cod)2和AlMe3存在的条件下,反应活性和选择性可以得到较大提高。当使用可以同时锚定两种金属的二级膦氧配体时,反应得到单一的5-exo产物。当采用廉价酒石酸酯骨架的手性二级膦氧配体时,100 ℃ 条件下,1个小时内就可以高达98%的收率和99%的对映选择性得到多种β位手性的双环或多环咪唑类衍生物。反应具有良好的底物适用范围,无论是单取代还是二取代和三取代的烯烃都可以很好地参与反应。芳香环上的各种取代基,包括C-Br键都能很好地兼容。反应的催化剂较为廉价易得,反应条件相对温和,且可以获得优异的立体选择性,为一步高效合成β位手性的咪唑类衍生物提供方便、实用的方法。
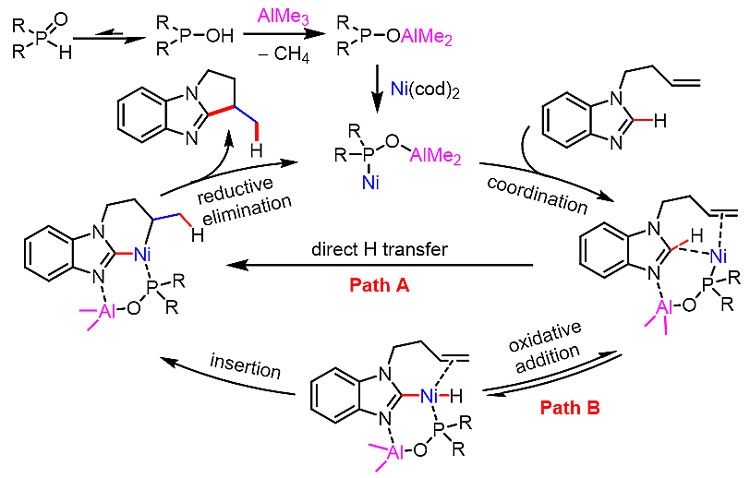
基于双金属催化的机理,作者提出了两种可能的环化途径,一种是直接氢转移的路径A,一种是氧化加成的路径B。氘代实验更倾向于路径A,但是路径B也不能完全排除。
这一成果近期发表J. Am. Chem. Soc. 上,文章的第一作者为南开大学化学学院博士研究生王银霞。
该论文作者为:Yin-Xia Wang, Shao-Long Qi, Yu-Xin Luan, Xing-Wang Han, Shan Wang, Hao Chen and Mengchun Ye
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantioselective Ni−Al Bimetallic Catalyzed exo-Selective C−H Cyclization of Imidazoles with Alkenes
J. Am. Chem. Soc., 2018, 140, 5360, DOI: 10.1021/jacs.8b02547
导师介绍
叶萌春
http://www.x-mol.com/university/faculty/40458
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号