《科学》:肠道微生物竟然成为肝脏肿瘤发展的帮凶!科学家发现微生物代谢产物特异性调节肝脏肿瘤免疫的机制
本文获“奇点网”授权转载,版权归“奇点网”所有,任何转载需获得“奇点网”授权。
随着肠道微生物研究的崛起,研究人员逐渐确立了它们与多种疾病间的关系,癌症就是其中的“大户”。大量研究表明,一些肠道微生物可以促进癌症的发生、帮助癌细胞转移、导致化疗耐药和影响免疫治疗的效果,可以说是全方位,多角度。研究涉及的癌种也不局限于肠癌,还包括白血病、胰腺癌和黑色素瘤等等。
这个名单还在持续扩大,在最近的《科学》杂志上,来自美国国立卫生研究院(NIH)的Tim Greten博士的团队发现,肠道微生物可以通过代谢产物胆汁酸特异性调节肝脏中一种免疫细胞——自然杀伤T(NKT)细胞的数量,从而调控肝脏肿瘤的生长!他们找到了完整的调控通路,从机制上证实了肠道微生物与肝脏抗癌免疫之间的相互作用[1]。

Tim Greten博士
研究人员分别用了三种不同的癌细胞系给小鼠进行皮下注射,形成皮下肿瘤的同时,癌细胞还会自发地转移到肝脏或者肺中,形成肿瘤。在研究人员使用了“抗生素三连”(万古霉素+新霉素+西司他丁)后,奇妙的结果发生了,皮下和肺部的肿瘤都持续生长,但是肝脏中的肿瘤肉眼可见的变少变小了!
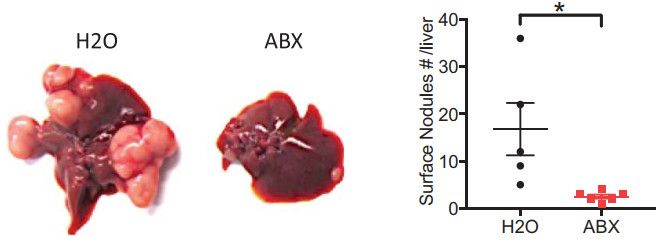
左:饮水中不加入抗生素的小鼠(H2O)和加入抗生素小鼠(ABX)的肝脏
右:饮水中不加入抗生素的小鼠(H2O)和加入抗生素小鼠(ABX)肝脏中肿瘤的数量
肝脏为什么如此特殊?因为肠道与肝脏之间特殊的联系方式——“胆汁酸”啊。胆汁酸是消化我们摄取的脂质的关键物质,根据来源不同可以分为初级和次级。
初级胆汁酸是在肝脏中以胆固醇为原料合成的,它会随着胆汁进入肠道中,被肠道微生物“利用”,脱掉一部分结构之后成为次级胆汁酸,少量胆汁酸会随着粪便排出体外,其余都会被肠上皮细胞吸收(初级、次级都有),通过门静脉血液回到肝脏中,以此往复。
实验表明,抗生素的使用增加了初级胆汁酸的水平,降低了次级胆汁酸的水平。如果直接给有肝脏肿瘤的小鼠喂食初级胆汁酸,也能够起到和抗生素差不多的效果。初级胆汁酸居然有抵抗肝癌的功效?为什么呢?
研究人员发现,随着初级胆汁酸的水平上升,负责招募免疫细胞的趋化因子CXCL16的水平也上升了。肝脏中CXCL16主要是由肝窦内皮细胞(肝脏细胞的一种,参与与周围组织的物质交换和免疫反应)产生的,实验也证实,肝脏肿瘤减少了的小鼠,肝窦内皮细胞的CXCL16表达增加。而且CXCL16也只在肝脏中增加,同样有肿瘤侵袭的肺部就没有这种现象。
CXCL16需要和免疫细胞表面的受体结合才能发挥作用,这个受体就是趋化因子受体6(CXCR6),CXCL16是它唯一的配体。
研究人员发现,在抗生素治疗后,肝脏中聚集了很多表达CXCR6的NKT细胞。这是T细胞的一种亚型,从名字也可以看出来,它兼具T细胞和自然杀伤(NK)细胞的性质与功能,也是人体必需的免疫细胞。在实验中,NKT细胞的增加和聚集出现在肿瘤被消灭之前,而且“消灭”的效果是由NKT细胞带来的,而不是同时存在于肝脏中的其他T细胞。

抗生素的使用导致初级胆汁酸增加,次级胆汁酸减少,而肠道微生物是将初级胆汁酸转化为次级胆汁酸的“转化者”,这就说明一些参与了转化过程的肠道微生物被抗生素杀死了。
是谁?是梭菌属(Clostridium )细菌。将初级胆汁酸转化为次级需要一种特殊的酶,有这种酶的肠道微生物并不多,梭菌属其中一类。研究人员使用的三种抗生素中的万古霉素正好能够靶向杀死包含梭菌属细菌在内的革兰氏阳性菌(革兰氏染色实验呈紫色的细菌,阴性菌呈红色,两类菌染色的差异取决于细胞壁结构的不同,阴性菌与阳性菌对抗生素的敏感性不同),单独使用万古霉素进行实验也确实大量杀死了梭菌属细菌,NKT细胞的数量也和三种抗生素联合使用时差不多。
过去的研究发现,它可以使肠道中的初级胆汁酸增加,次级胆汁酸大量减少[2]。为了证明梭菌属细菌的作用,研究人员从中选择了一个代表:Clostridium scindens,它能够代谢初级胆汁酸,而且在人和小鼠的肠道中都是常见菌种[3]。
将它成功定植给用万古霉素处理过的小鼠后,与对照组相比,小鼠的梭菌属细菌丰度得到了一定的弥补,初级胆汁酸的水平减少,肝脏中的NKT细胞数量急剧下降,而其他免疫细胞都没有受到影响。同时,肝脏中也出现了更多肿瘤。
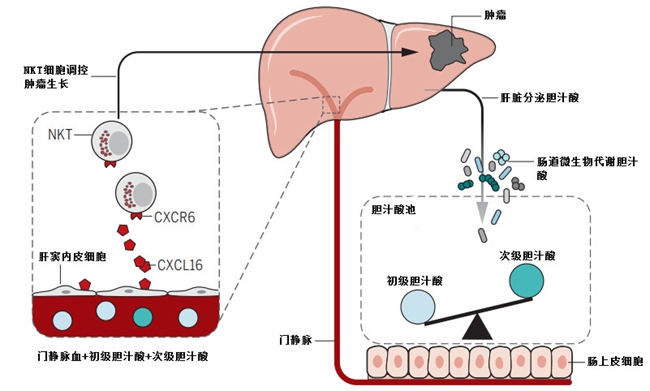
肠道微生物通过胆汁酸对肝脏中自然杀伤T细胞和肿瘤的调节
也就是说,梭菌属细菌调控着胆汁酸的代谢,将它们从初级转化为次级,当抗生素杀死了大量梭菌属细菌后,初级胆汁酸的转化减少,回到肝脏中的变多,刺激肝脏中产生更多的趋化因子CXCL16,招募到更多的NKT细胞,杀灭了肝脏肿瘤。也就是说,在肿瘤发生后,我们的常见肠道微生物竟然扮演了一个帮凶的角色?减少了招募NKT细胞的初级胆汁酸,让肿瘤肆意生长?
研究人员表示,这个机制不仅仅在小鼠中存在,在人类中可能也是成立的。通过检测肝癌患者的非肿瘤肝脏组织,他们发现CXCL16的表达水平与初级胆汁酸的水平呈正相关关系,与次级胆汁酸呈负相关。
Greten博士认为,虽然很多研究发现肠道微生物和免疫反应之间存在关联,但这次研究的重要性在于它提供了一个完整的机制。而且胆汁酸在人的肝脏中也调控着CXCL16的表达,这就为肝癌的临床治疗提供了一些新的思路,比如通过调控胆汁酸的代谢来帮助免疫系统抑制肿瘤的生长[4]。
除此之外,同期发表的评论文章指出,高脂饮食能够诱导梭菌属细菌丰度的增加,导致次级胆汁酸水平的上升,显然,这对肝癌患者是很不利的[5]。
另外,人与小鼠有一个很重要的不同点——小鼠肝脏中的NKT细胞占肝脏内全部T细胞的40%,数量很庞大,而人肝脏中的NKT细胞比小鼠少很多。不过,这个差异或许能够被一种名为粘膜相关恒定T细胞(MAIT)的T细胞所弥补,它们在人的肝脏中广泛存在,也表达CXCR6,而且和自然杀伤T细胞一样分泌γ干扰素等细胞因子[6]。
不过针对MAIT抗肿瘤效果的研究还很少,未来,这个领域还有很多可以挖掘的东西,MAIT也有机会成为一个新的抗肿瘤小能手,帮助医生和研究人员改善肝癌患者的治疗。
参考资料:
[1] Ma C, Han M, Heinrich B, et al. Gut microbiome–mediated bile acid metabolism regulates liver cancer via NKT cells[J]. Science, 2018, 360(6391): eaan5931.
[2] Theriot C M, Bowman A A, Young V B. Antibiotic-induced alterations of the gut microbiota alter secondary bile acid production and allow for Clostridium difficile spore germination and outgrowth in the large intestine[J]. MSphere, 2016, 1(1): e00045-15.
[3] Buffie C G, Bucci V, Stein R R, et al. Precision microbiome reconstitution restores bile acid mediated resistance to Clostridium difficile[J]. Nature, 2015, 517(7533): 205.
[5] Hartmann N, Kronenberg M. Cancer immunity thwarted by the microbiome[J]. Science, 2018, 360(6391): 858-859.
[6] Chandra S, Kronenberg M. Activation and function of iNKT and MAIT cells[M]//Advances in immunology. Academic Press, 2015, 127: 145-201.
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号