Making Smart Drugs Smarter:基于“浓集激活”的前药策略,开启前药设计的新篇章
智能药物是将靶向分子和药物分子连在一起的前体药物或前药(prodrug),就如同导弹一样,在靶向分子的指引下将所带药物精确地送达预期的靶部位,从而达到高特异性的浓集作用。然而,只把药物浓集到靶部位还是不够的,接下来需要将具有生物活性的原药物“弹头”释放出来,这也是非常关键的一步。如今,在该领域智能药物选择性在靶部位的浓集已实现,如单抗偶联药物(antibody-drug conjugate,ADC)或以受体底物做导向的药物。然而,实现药物在靶部位的可控释放仍是一个难题。最近,通过linker chemistry的巧妙设计,美国佐治亚州立大学化学系王炳和(Binghe Wang)教授(点击查看介绍)课题组开发了基于“浓集激活(enrichment-triggered activation)”的前药策略,在很大程度上解决了可控释放这一难题(图1)。
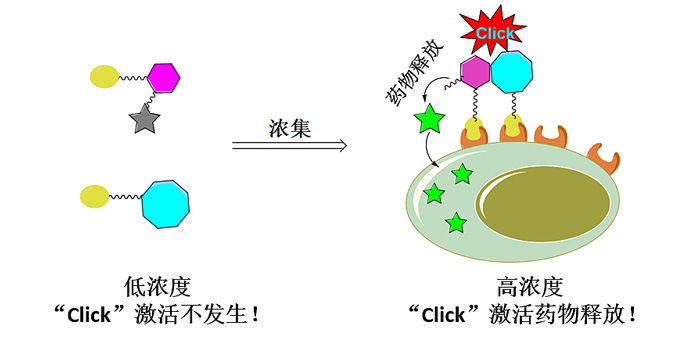
图1. 基于浓集激活的前药策略。图片来源:王炳和课题组
具体来讲,设计前药的基本原则是必须使官能团的化学衍生化具有生物可逆性。即,在理想状态下,前药在体循环过程中非常稳定;而在到底靶部位后,由于微环境的变化(如pH、或特定酶表达水平的升高),前药能转化为母体药物而发挥药效(如ADC)。传统前药的设计主要依赖于内源性的小分子(如GSH、ROS等)或者酶来激活前药,并在改善候选药物的成药属性方面取得巨大的成功。但是,当前药的设计是以靶向输送为目的时(如ADC),传统前药设计的策略存在一个严重的缺陷——前药在非靶部位的非特异性激活,因为前药激活所需的刺激均是内源性的、无处不在的小分子或者酶。近年来,利用“点击化学(click chemistry)”设计的生物正交前药(bioorthogonal prodrugs)正好可以弥补传统前药设计的一些不足。简单的说,生物正交前药的激活并不依赖于内源性刺激,而是通过与一个外源性的化合物在生理条件下进行click反应而释放母体药物。因此,通过在特定的时间和靶部位注射第二个化合物,可以实现母体药物的特异性释放。不过,将生物正交前药转化到体内甚至是临床应用还面临着许多挑战,其中最主要的是需要解决生物正交前药体内给药的问题,即,怎么协调生物正交前药双组分体内的药代动力学属性以确保二者能选择性地在靶部位发生click反应而释放母体药物。
最近,王炳和教授首创性的提出基于“浓集激活”前药的全新概念,有望解决生物正交前药体内给药的难题。简单的说,该策略利用click反应的动力学来实现母体药物在靶部位的特异性释放。在体循环过程中,参与click反应的双组分浓度较低(如10 μM),因此二者之间的click反应会非常慢(如t1/2> 100 h, k =~0.2 M-1s-1),相应母体药物的非特异性释放可忽略。而当靶分子将二者浓集到靶部位后,由于局部浓度的显著增加(如400 μM),二者之间的click反应速率也会增加(如t1/2 = 2h),因此母体药物也就能特异性地在靶部位释放(图1)。
靶向线粒体多柔比星的输送
基于该概念,王教授课题组的博士生郑月钦(Yueqin Zheng)设计了靶向癌细胞线粒体的多柔比星(doxorubicin)输送。如图2所示,化合物1和2在近生理条件下发生click反应生成中间体3(k = ~0.2 M-1s-1),进一步的内酯化释放多柔比星(Dox-NH2)。而在没有化合物2存在的情况下,化合物1在37 ℃孵育24 h后也没有检测到多柔比星的释放,从而证明了Dox-NH2释放的特异性。已有文献报道,三苯基膦盐(P+Ph3Br-, TPP)能高效靶向且浓集于线粒体(~1000倍)。为了能实现靶向线粒体的特异输送,化合物1a/2a与TPP偶联得到化合物1b和2b。细胞毒性试验证明TPP偶联得到化合物1b和2b可以在线粒体浓集,并快速释放母体药物,初步验证了基于浓集激活前药在体外的可行性。
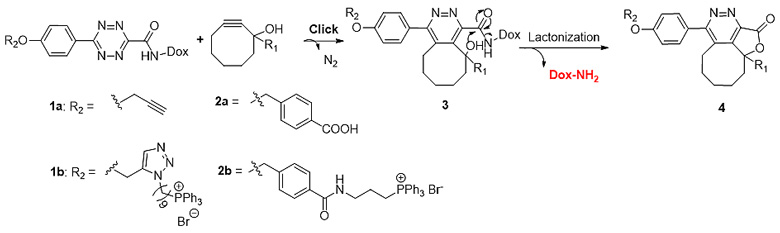
图2. 基于Click-cyclize-release策略的浓集激活前药。图片来源:王炳和课题组
靶向线粒体一氧化碳的输送
为了证明该概念在体内的可行性及药理作用,王教授课题组的季兴跃(Xingyue Ji)博士设计了靶向线粒体的一氧化碳(CO)输送。CO是哺乳动物体内重要的气体信使小分子,同时也具有广泛的生物活性,具有很好的临床应用前景。大量的研究显示,CO主要靶向细胞线粒体,因此设计靶向线粒体的CO输送将有望大大改进CO的药效属性。鉴于此,季兴跃博士设计并合成了基于生物正交反应的CO前药5a/6a,并同时利用浓集激活前药的理念在5a/6a结构中引入靶向线粒体的TPP基团,得到化合物5b/6b。同时,为了能够直观的实时监测click反应的进程,在环戊二烯酮的3,4位引入萘环(5a/b),使得click反应后的产物7a/b具有蓝色荧光的属性,以实时监测CO的释放。
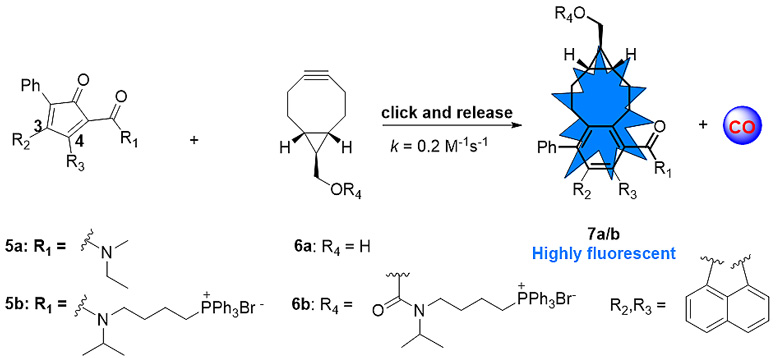
图3. 基于“浓集激活”的靶向线粒体的CO前药。图片来源:王炳和课题组
随后的细胞影像实验表明,经过5a和6a(1 μM,5 μM)共处理4h的Raw264.7细胞并没有显现出明显的蓝色荧光。而在相同条件下,经过5b和6b共处理的细胞却显现出明显的剂量依赖的蓝色荧光,且随后的共聚焦显微镜下的共定位实验表明,蓝色荧光主要集中在线粒体。这些研究结果表明,基于浓集激活的CO前药成功的实现了在线粒体的特异性释放。
为了验证靶向线粒体的CO输送是否能改善CO的药效属性,王教授课题组还在Raw264.7细胞中评价了化合物5a/6a、5b/6b抑制细菌脂多糖(LPS)诱发的肿瘤坏死因子(TNF)分泌的活性。结果显示,靶向线粒体的CO输送(5b/6b)能剂量依赖性地抑制TNF的分泌,IC50 仅为5 μM。值得一提的是,5 μM也是王教授实验室在同等条件下对所有有机CO前药筛选所得到的最低IC50值,表明靶向线粒体输送确能改善CO的药效属性。同时对照组(5a/6a)在10 μM 浓度下也未能体现出明显的抗炎活性。
为了进一步验证该策略也能应用于体内,王教授课题组与哈佛大学医学院的Leo Otterbein教授课题组合作,评价了化合物5b/6b及5a/6a对由对乙酰氨基酚(APAP)引起的小鼠急性肝损伤的保护作用。实验结果显示,化合物5b/6b在尾静脉注射0.4 mg/kg的剂量下能显著降低(50%)由APAP引起的丙氨酸转氨酶升高,而化合物5a/6a在相同的剂量下却没有相似的效果。随后的组织学染色实验也表明,化合物5b/6b治疗组明显改善由APAP引起的细胞死亡。
综上,这些研究结果在分子、细胞和动物水平证明了基于“浓集激活”的前药策略的有效性。可以预见,当与其他靶向分子偶联后,该策略可用于靶向其他疾病/组织的药物输送,从而提高药物靶向输送的特异性,降低脱靶效应。
上述研究成果发表在Nature Chemistry 上,佐治亚州立大学的博士生郑月钦与季兴跃博士为该文章的共同第一作者,哈佛大学医学院的Leo Otterbein教授与佐治亚州立大学的王炳和教授为该文章的通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enrichment-triggered prodrug activation demonstrated through mitochondria-targeted delivery of doxorubicin and carbon monoxide
Nat. Chem., 2018, DOI: 10.1038/s41557-018-0055-2
导师介绍
王炳和
http://www.x-mol.com/university/faculty/5237
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号