稀土元素氧化物在库普弗细胞内引发细胞焦亡
随着工程纳米材料在生物医学领域的广泛应用,无论是作为颗粒摄取和从主要暴露部位的扩散,还是通过静脉注射的治疗和成像纳米颗粒,肝脏和单核吞噬细胞系统是工程纳米材料的主要靶标。
近日,加州大学洛杉矶分校的夏天教授、André E. Nel教授、Vahid Mirshafree博士,大连理工大学精细化工国家重点实验室的孙冰冰教授等使用库普弗细胞和肝细胞对29种金属氧化物纳米颗粒的毒理学进行了比较分析,首次应用高质量的纳米材料库进行无偏见的毒性筛选。他们通过研究,观察到库普弗(Kupffer)细胞和肝细胞之间的差异,并观察到过渡金属氧化物与稀土氧化物的毒理学特征差异。虽然促氧化性的过渡金属氧化物可诱导半胱天冬酶3和7活化,导致两种细胞类型的凋亡性细胞死亡,但稀土氧化物诱导库普弗细胞中的溶酶体损伤、NLRP3炎性体激活、半胱天冬酶1激活和细胞焦亡。细胞焦亡伴随着细胞肿胀、膜泡化(图一)、IL-1β释放和膜通透性增加,通过敲减成孔蛋白gasdermin D来逆转。这种独特的细胞死亡机制是由系统氧化物的理化性质造成的。稀土纳米材料在酸性条件下不稳定,而溶解的稀土离子可以与磷酸根结合,形成海胆状结构。当该转化过程发生在溶酶体中,溶酶体膜上的磷脂分子失去磷酸根,导致溶酶体破裂以及下游NLRP3炎性体激活和焦亡的过程(图二)。虽然他们在肝细胞中没有看到相似的特征,但是研究发现,稀土氧化物对巨噬细胞系如J774A.1和RAW 264.7细胞以及骨髓衍生的巨噬细胞引发相似的焦亡作用,由此说明这是普遍的规律。这种特殊的细胞死亡机制可能对纳米材料的急慢性毒性具有重要的影响,后续的研究目前正在进行中。
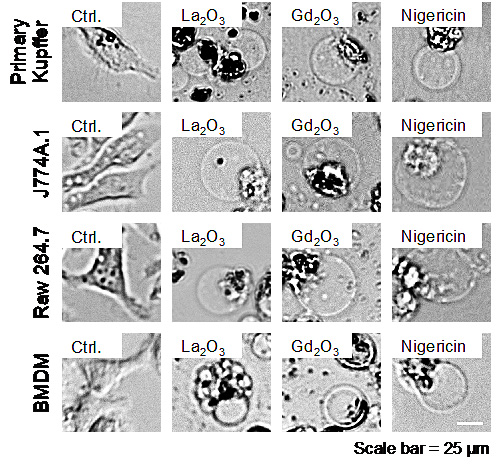
图1. 稀土氧化物在巨噬细胞中引发细胞焦亡
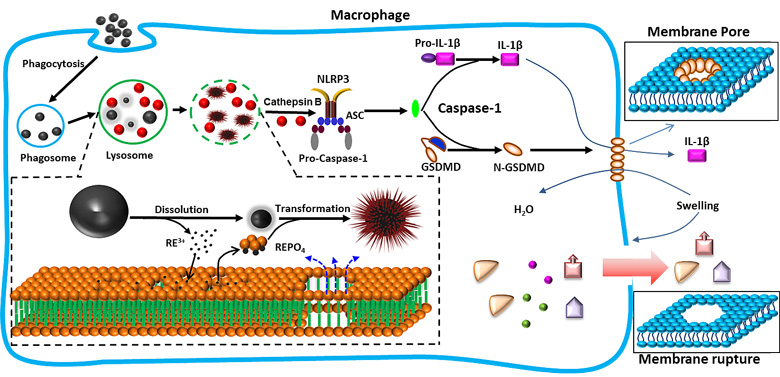
图2. 稀土氧化物引发细胞焦亡的机制
大连理工大学精细化工国家重点实验室的孙冰冰教授及加州大学洛杉矶分校的博士后Vahid Mirshafree为共同第一作者,加州大学洛杉矶分校的夏天教授和André E. Nel教授为通讯作者。该研究工作发表在ACS旗下的纳米科学期刊ACS Nano 上。
该论文作者为:Vahid Mirshafree, Bingbing Sun, Chong Hyun Chang, Yu-Pei Liao, Wen Jiang, Jinhong Jiang, Xiangsheng Liu, Xiang Wang, Tian Xia, André E. Nel
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Toxicological Profiling of Metal Oxide Nanoparticles in Liver Context Reveals Pyroptosis in Kupffer Cells and Macrophages versus Apoptosis in Hepatocytes
ACS Nano, 2018, 12, 3836, DOI: 10.1021/acsnano.8b01086
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号