手性伯胺催化环己酮的脱氢反应构建羰基γ位手性中心
羰基化合物是有机化合物中一类重要的物质,围绕羰基化合物(醛、酮、羧酸、酯、酰胺等)发生的转化一直都是有机化学研究的重点和热点,手性羰基化合物的合成更是其中重要也十分具有难度的方向。由于羰基化合物自身结构的高度极化性,α位碳-氢键相比于其他碳-氢键具有更强的酸性,围绕羰基化合物进行的不对称催化转化大多集中在α位和羰基碳的位置,远端手性中心的形成一直都是不对称催化领域研究的重点和难点(图1)。
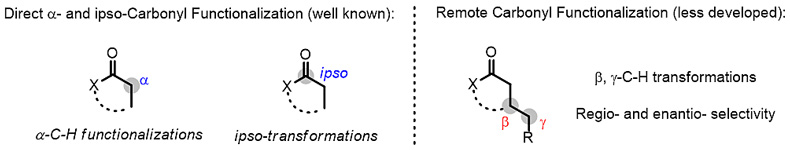
图1. 手性羰基化合物的合成
羰基化合物和氨基催化剂形成的富电子烯胺中间体发生氧化构建羰基远端手性中心是一种行之有效的方式。最近,中国科学院化学研究所的罗三中研究员(点击查看介绍)利用手性伯胺催化体系与2-碘酰基苯甲酸对酮进行氧化脱氢,成功通过4-取代环己酮的脱氢去对称化反应构建了羰基化合物γ位的手性中心。
羰基化合物烯胺中间体的氧化历程在此前已有报道,该过程主要经过单电子氧化(SOMO催化)和脱氢氧化(氧化亚胺催化)两种途径。其中通过SOMO催化构建羰基远端手性中心的工作尚无报道,而通过氧化亚胺催化构建羰基β位手性中心的报道仅局限于醛类化合物(图2-I)。因此,酮化合物远端手性中心的形成仍然是不对称催化领域尚未解决的难题。
羰基化合物直接脱氢是最直接的构建不饱和键的方法,近年来受到了广泛的关注,虽然该领域近年来已经有许多出色的报道,但反应的选择性仍然是脱氢反应中的重点和难点,对映选择性脱氢反应更是尚未实现。基于此,罗三中课题组发展了使用手性伯叔二胺作为催化剂,市售的2-碘酰基苯甲酸作为氧化剂的4-取代环己酮的对映选择性脱氢反应,高效地构建了酮羰基γ位叔碳和季碳手性中心(图2-II)。
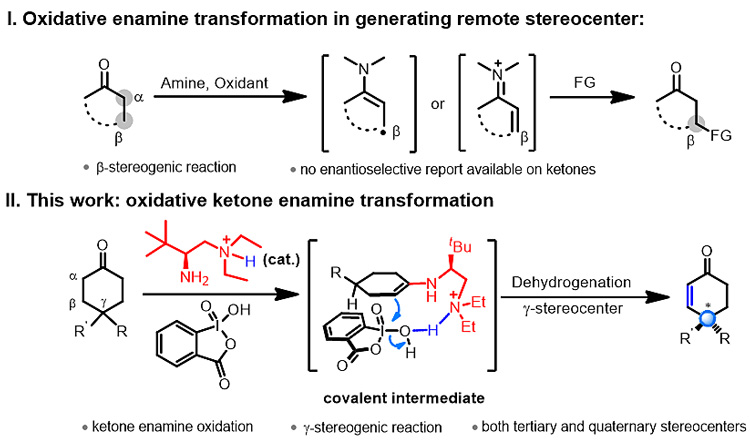
图2. 通过烯胺氧化脱氢历程构建羰基γ位手性中心
在最优条件下,作者对不同4-取代环己酮底物进行考察。结果表明,4位单取代和双取代的底物参与反应都能得到较好的结果,双键、酯基、芳基等取代基都具有良好的兼容性。由于反应中氧化剂2-碘酰基苯甲酸为0.5当量,转化的最大产率为50%(图3)。
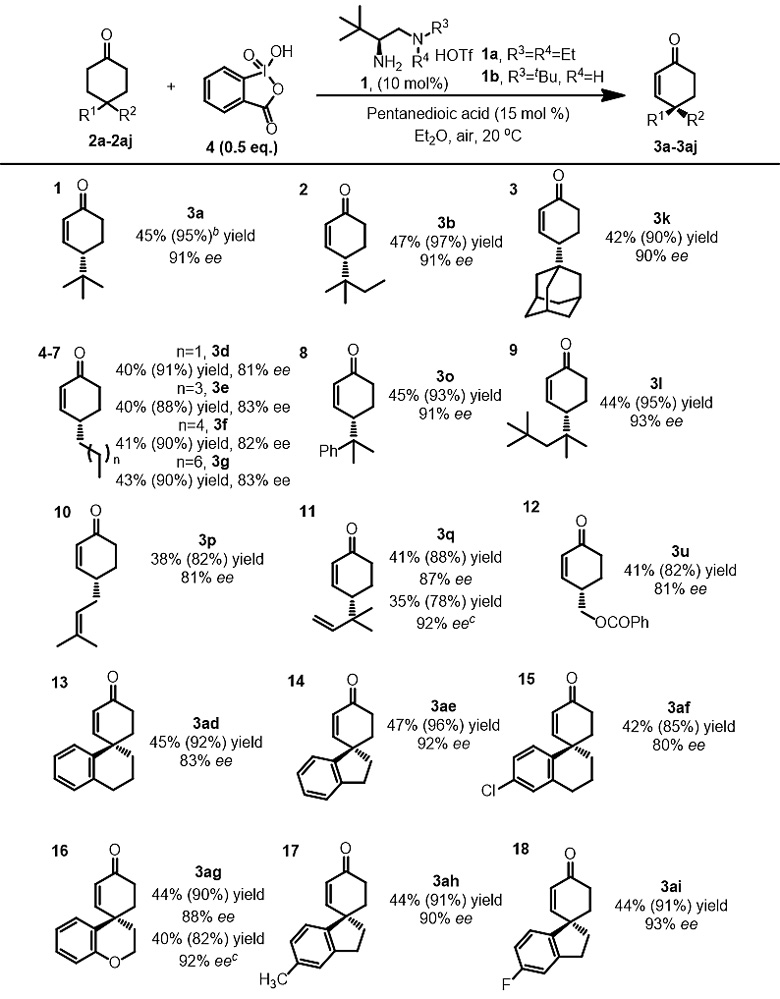
图3. 去对称化反应的底物适用范围
通过一系列的机理研究,作者提出了反应的机理和手性控制模式:手性伯胺催化剂和4-取代环己酮形成两种存在热力学平衡的烯胺中间体。通过氢键和位阻协同控制模式,其中一种中间体对2-碘酰基苯甲酸发生亲核取代反应,得到羰基α位碳-碘键形成的中间体,随后发生同面的协同质子攫取得到手性不饱和亚胺,并水解得到最终产物(图4)。
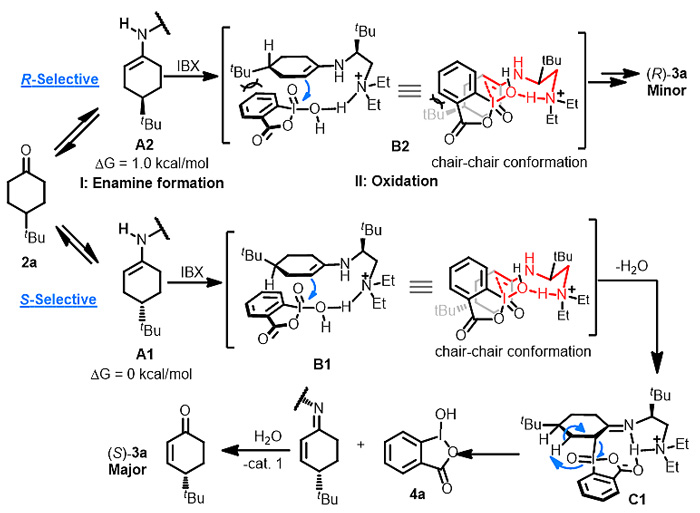
图4. 推测的反应机理和手性控制模式
——总结——
罗三中课题组发展了手性伯胺催化剂催化4-取代环己酮的不对称脱氢反应,成功构建了羰基γ位叔碳及季碳手性中心。该反应经历共价中间体,发生2-碘酰基苯甲酸对酮烯胺的协同不对称脱氢过程,对各类底物都具有很好的兼容性,为烯胺氧化的进一步发展提供了新的可能性。
该论文作者为:Lihui Zhu, Long Zhang, Sanzhong Luo
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalytic Desymmetrizing Dehydrogenation of 4-Substituted Cyclohexanones through Enamine Oxidation
Angew. Chem. Int. Ed., 2018, 57, 2253, DOI: 10.1002/anie.201713327
导师介绍
罗三中
http://www.x-mol.com/university/faculty/15535
课题组主页
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号