Nature:破解耐药菌难题的“攻壳机动队”
说到病原微生物中的革兰氏阴性菌,医学界有两个说法,叫“谈阴色变”和“阴盛阳衰”,足见这类微生物是威胁人类健康的“狠角色”。若要问它们有多狠,请各位看这两位恶名昭彰的成员—鼠疫耶尔森菌(Yersinia pestis,图1右)和霍乱弧菌(Vibrio cholerae,图1左),前者在我国39种法定传染病中位居甲类第一位(俗称1号病),引发了欧洲中世纪的黑死病和上世纪初哈尔滨的鼠疫大流行,后者是排位仅次于鼠疫的甲类传染病(又称2号病),曾肆虐于埃及、孟加拉、印度等地区,两者都曾在历史上造成极高死亡率,至今仍然是人类疾病史上挥之不去的梦魇。
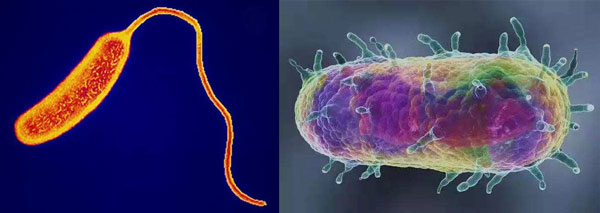
图 1. 霍乱弧菌(左)和鼠疫耶尔森氏菌(右)菌体形态。图片来源于网络
除了前面两位成员之外,在临床分离到的致病菌中,革兰氏阴性菌所占比例已接近四分之三,革兰氏阳性菌只占四分之一多点,呈现“阴盛阳衰”的局面(图2)。更令人担忧的是,以鲍曼不动杆菌(Acinetobacter baumannii)、铜绿假单孢菌(Pseudomonas aeruginosa)、肠杆菌属(Enterobacter)为代表的革兰氏阴性耐药菌在临床上已经对碳青霉烯或第三代头孢菌素产生抗性,尤其是对“抗生素的最后屏障”粘菌素(colistin)产生耐药性的问题引起了全球医学界的担忧。
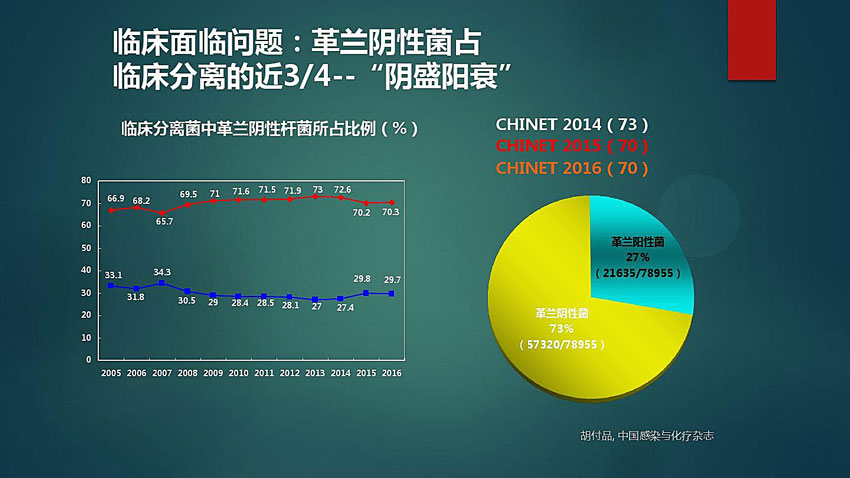
图2. 2005-2016年临床分离到的革兰氏阴性菌比例。图片数据来源:《中国感染与化疗杂志》[1]
革兰氏阴性菌的细胞壁如同“复合装甲”,呈现“内-中-外”(内膜-肽聚糖-外膜)的三明治型结构,把菌体保护得非常严实。外膜上面还有脂多糖(LPS),如同金庸小说中黄蓉身上的“软猬甲”一般柔软但坚固,很容易就可将抗生素的攻击阻挡在外。耐药性革兰氏阴性菌,针对抗生素的“攻壳”行为还进化出一系列对抗机制保护自己。过去50年,还没有抑制革兰氏阴性菌的新机制抗生素获批 [2]。研究开发出针对革兰氏阴性菌的新抗生素已经成为医药界想要破解的世纪难题。
近日,瑞士Polyphor AG制药公司的Daniel Obrecht博士团队和瑞士苏黎世大学化学系的John A. Robinson教授团队及其合作伙伴报道了一系列对革兰氏阴性菌具有广谱抗菌活性的嵌合拟肽抗生素,并阐释了其“攻壳”作用新机制。相关论文发表于Nature。
他们的灵感来自于环肽类天然产物Murepavadin。Murepavadin含有β-发卡式结构,在之前的研究中发现它能够靶向革兰氏阴性菌的桶型β折叠外膜蛋白(outer membrane proteins, OMPs)。Murepavadin是第一个进入临床后期开发的靶向外膜蛋白抗生素。考虑到多粘菌素B(polymyxin B, PMB)和粘菌素(colistin)作用于外膜脂多糖部分。他们将β-发卡环肽进行修饰改造,并与多粘菌素B(PMB)结合,构建出化合物3、4、7、8以期获得同时靶向外膜蛋白(OMPs)和脂多糖(LPS)的抗生素(图3)。(这里有个小插曲:图3中结构有错误,化合物4的Dab24应该是Thr24,化合物5的Dab N端和Trp C端应该更正为Dab C端和Trp N端,作者已发布更正声明并修改)
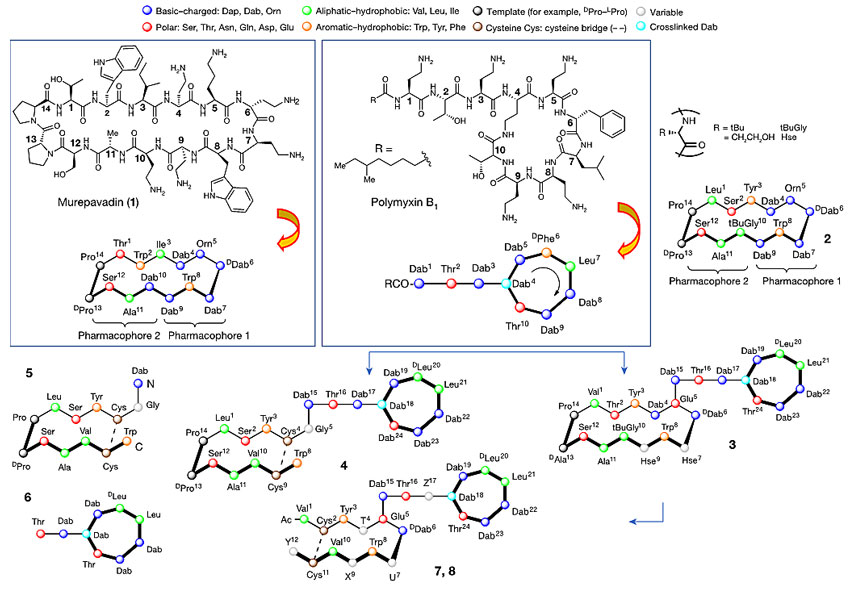
图3. 抗生素Murepavadin(1)、Polymyxin B1、化合物2-8的结构。图片来源:Nature
随后,他们以临床上常用的抗生素美罗培兰、头孢他啶、妥布霉素和粘菌素作为对照,对合成的化合物进行一系列针对耐药性菌的抗菌活性测试。结果显示,化合物3、4、7、8对一系列临床上分离的耐药性革兰氏阴性菌都有很高的抗菌活性(MIC值从0.03到0.25 mg/L,图4),尤其是能够抑制的耐粘菌素菌株;而且,对革兰氏阳性菌和真菌无明显抑制活性。有趣的是,他们还发现化合物的活性具有立体选择性(4和8的对映异构体e-4和e-8抗菌活性显著下降)。
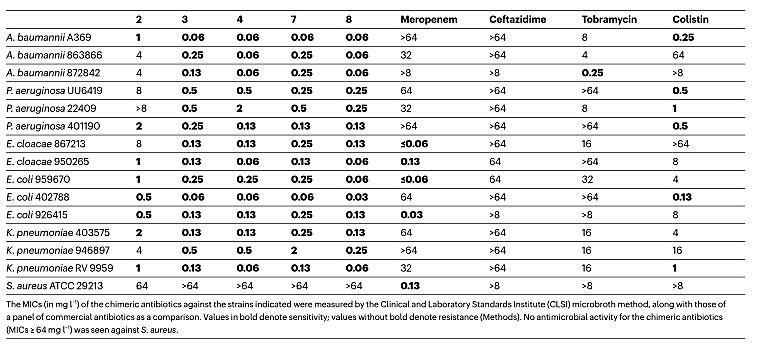
图4. 化合物2、3、4、7、8、美罗培兰、头孢他啶、妥布霉素和粘菌素的抑菌活性评价。图片来源:Nature
由于4的体内药代动力学和药效学并不理想。他们选择3、7、8做生物安全性测试,发现3、7、8对人类细胞(HeLa)有较低细胞毒活性。在中性粒细胞减少的小鼠感染模型中,3对败血症或腹膜感染模型,8对腹膜或股部感染模型显示出良好的疗效。在小鼠急性肾毒性模型评估中,7和8显示轻度肾毒性(得分1和2),相比而言粘菌素显示更高的肾毒性(得分24)。
在作用机制研究中,他们以大肠杆菌E. coli ATCC 25922为模型,未发现化合物3、4对大肠杆菌蛋白质、DNA、RNA和细胞壁的生物合成有任何影响,但发现3、4能穿透整个细胞被膜(cell envelope)。他们使E. coli 暴露于化合物3、4,并用细胞膜染料FM4-64、核酸染色剂DAPI和SYTOX-Green处理E.coli,用STED荧光显微镜检测细胞通透性。结果发现,染上DAPI的核酸未受3、4的影响,经3、4处理的多数细胞在SYTOX-Green存在下显示强绿色荧光,再次表明3、4对大肠杆菌细胞内膜和外膜的穿透效应。一些3、4处理过带有FM4-64染料的细胞膜呈现红色荧光斑点,提示膜结构受到破坏。他们进一步将染料Alexa Fluor 488与3、4连接制备化合物fl-3和fl-4。经检测,fl-3和fl-4依旧保留抗菌活性。再用STED荧光成像检测fl-3和fl-4处理过的E. coli,发现亮绿荧光点集中在膜上,这表明化合物的主要作用位点在细胞被膜上的OMP簇(图5 a-d)。经透射电子显微镜发现,E. coli 经3或4处理后膜结构发生明显变化,观察到了额外的膜状物质、膜脱离和液泡样结构,表明化合物3、4破坏了大肠杆菌的细胞膜(图5e)。
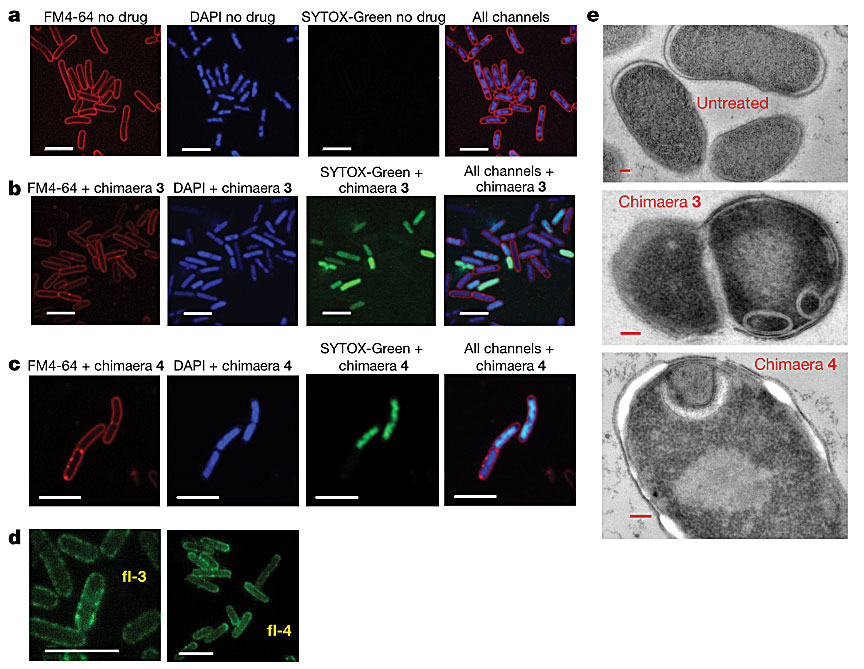
图5. a-d 荧光显微镜检E. coli ATCC 25922 使用染料FM4-64、DAPI、SYTOX-Green,(a) 未加抗生素,(b) 加3处理,(c) 加4处理,(d) 荧光标记fl-3和fl-4处理,(e) 透射电子显微镜检E. coli 未加抗生素、加3、加4。图片来源:Nature
为寻找3、4、7在细菌细胞膜上的作用靶点,他们采用光亲合互作映射技术(Photo-affinity interaction mapping),构建光亲和探针衍生物PAL-3、PAL-4和PAL-7。经检验,3个探针依然保留了抗菌活性。他们将探针与细菌细胞进行光交联,随后进行亲合纯化并用蛋白质组学技术进行蛋白鉴定。经分析,对于PAL-4处理的细胞,外膜蛋白BamA和LptE得到显著富集。细胞经PAL-3处理后,蛋白BamA、BamD和LamB被明显富集(图6)。PAL-7处理后,则更多的外膜蛋白BamA、BamD、LptE和LamB被富集。BamA是唯一被3个光学探针标记的外膜蛋白,它是BAM折叠酶复合体(BAM foldase complex)的关键成分。
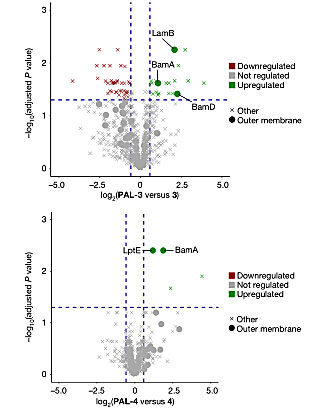
图6. 光亲合互作映射显示探针PAL-3富集到BamA、BamD和LamB(上),探针PAL-4富集到BamA、LptE(下)。图片来源:Nature
他们用高分辨核磁(NMR)来分析化合物3和BamA的相互作用结合位点。通过二维TROSY 谱[ 15N, 1H]分析3与BamAext(锁定在关闭状态的BamA 桶状折叠状态)结合位点的化学位移变化。在BamAext的胞外环状区域L4、L6和L7中观察到配体诱导的化学位移变化。非稳定BamA-β与3的微量热泳动(microscale thermophoresis, MST)滴定实验表明3与之互作改变了整体构象并稳定了BamA的封闭形式(图7)。
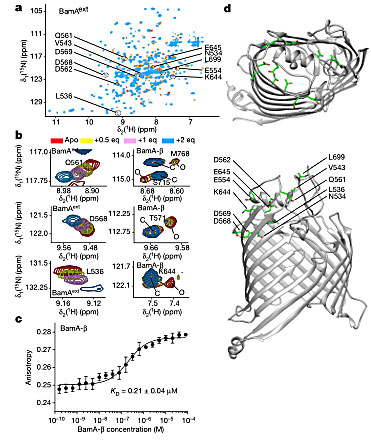
图7. 化合物3结合BamA。图片来源:Nature
他们还用化合物8和肺炎克雷伯氏菌K. pneumoniae SSI3010做抗性突变实验。结果表明,相比于粘菌素,化合物8对耐药性突变菌株的抑菌作用很微弱(MIC从0.06增加到0.125或0.5 mgL-1)。最后,通过基因bamA在菌株中的回补实验再次证实BamA在化合物8的抗菌活性中扮演着重要角色。
至此,作用于耐药性革兰氏阴性菌外膜蛋白的嵌合拟肽抗生素像“攻壳机动队”一样交出一份满意答卷。不难看出,它们大杀四方(广谱抑制各类革兰氏阴性菌)、专打精锐(尤能应对粘菌素抗性菌株)、除暴安良(极低的哺乳细胞毒性和肾毒性,在小鼠感染模型中显示了良好的治疗效力)。在应对威胁人类生命健康的革兰氏阴性菌这一强敌面前,基于这些衍生物的临床试验正有待展开,希望这支强劲队伍早日过关斩将投入抗击耐药菌的主战场。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Chimeric peptidomimetic antibiotics against Gram-negative bacteria
Nature, 2019, 576, 452–458, DOI: 10.1038/s41586-019-1665-6
参考资料:
2. 抗革兰氏阴性菌药物的研究进展, 药学学报[J],2019年09期
(本文由水村山郭供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号