唐本忠院士团队:水溶性 AIEgen 用于生物成像与光动力治疗
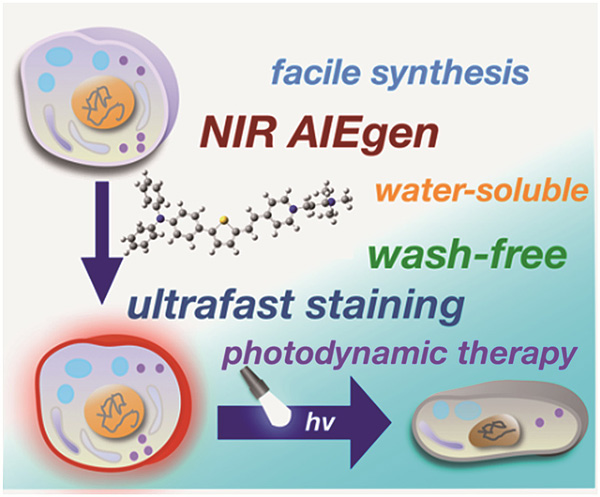
具有近红外区聚集诱导发光 (AIE) 特性和治疗诊断功能的水溶性 AIEgen(具有 AIE 性质的分子)一直是人们追求的目标,但前进的道路依然极具挑战性。近日,英国皇家化学会旗舰期刊 Chemical Science 发表了唐本忠院士团队(香港科技大学)与华南师范大学胡祥龙研究员、郑州大学第一附属医院苏会芳博士、深圳大学 AIE 研究中心王东博士等合作完成的前沿论文(Edge Article),首次报道了一种具有良好水溶性并能在近红外区发出强烈 AIE 荧光的 AIEgen。
这种 AIEgen 能够特异性地『照亮』细胞膜,而且在成像前无需洗去多余的荧光分子。在细胞培养基中加入 AIEgen 后,在室温下仅需晃动几秒钟就可以完成染色操作。这是首次报道能同时实现超快染色(秒级)和免洗脱操作的荧光『染色』分子。此外,本文还报道了所述 AIEgen 在可见光照射下高效生成活性氧物质(ROS)的研究工作;如此,该 AIEgen 不仅能成像,还能作为一种优异的光动力探针,实现肿瘤细胞的高效光动力杀伤。另外,由于该 AIEgen 能够稳定持久染色细胞膜,因此有望用于活体肿瘤的持久成像和治疗。
Rational design of a water-soluble NIR AIEgen, and its application in ultrafast wash-free cellular imaging and photodynamic cancer cell ablation
Dong Wang, Huifang Su, Ryan T. K. Kwok, Xianglong Hu*, Hang Zou, Qianxin Luo, Michelle M. S. Lee, Wenhan Xu, Jacky W. Y. Lam and Ben Zhong Tang*
Chem. Sci., 2018, Advance Article
DOI: 10.1039/C7SC04963C
非常感谢论文作者对本报道给出的修改意见!
研究背景
大显神威的 AIE
作为一种强大的非创伤性成像技术,荧光生物成像取得了长足的进步。作为其中主要使用的一类荧光生色团,有机小分子荧光生色团化合物也获得了很大的发展。得益于穿透深度大、生物自发荧光干扰少、对生物体造成的光损伤极小、光散射弱等特点,荧光激发波段位于近红外区(NIR,波长 > 700nm)的有机小分子化合物尤其受到关注。
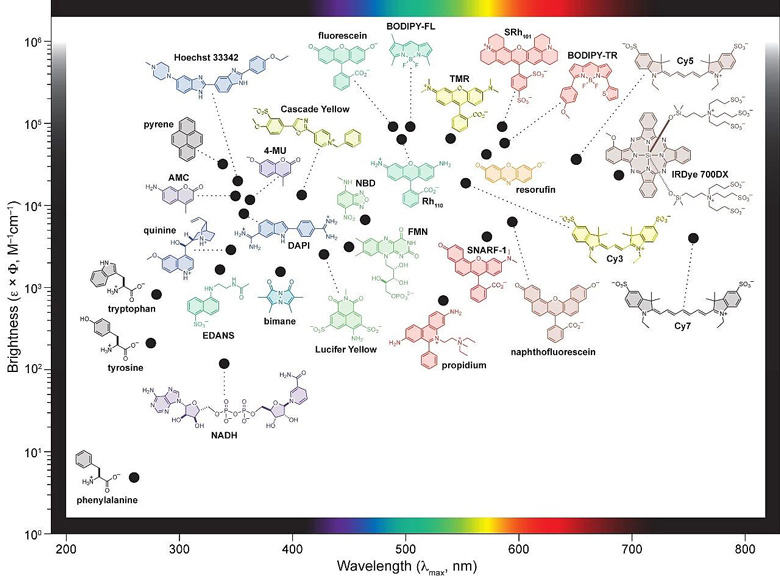
▲ 各类有机小分子荧光团化合物:最大激发波长与荧光强度。ACS Chem. Biol., 2008, 3, 142-155
然而,由于 π-π 堆积和其它非辐射衰变渠道的存在,传统的 NIR 荧光生色团在高浓度或聚集状态下只能发出较弱的荧光,或者完全不发光。上述这种荧光猝灭的主要原因跟聚集体的形成有关,故常被称为『聚集导致荧光猝灭』(aggregation-caused quenching, ACQ)。这种现象在生物成像和分析中非常常见,并且已经成为了影响实际应用的一个主要障碍:由于其发光中心的高疏水性,有机分子在生物介质中会自发地聚集在一起。
2001 年,唐本忠课题组发现了一个奇特的现象:一些噻咯分子在溶液中几乎不发光,而在聚集状态或固体薄膜下发光大大增强。因为此发光增强是由聚集所导致的,故被形象地将称为『聚集诱导发光』(aggregation-induced emission, AIE)。
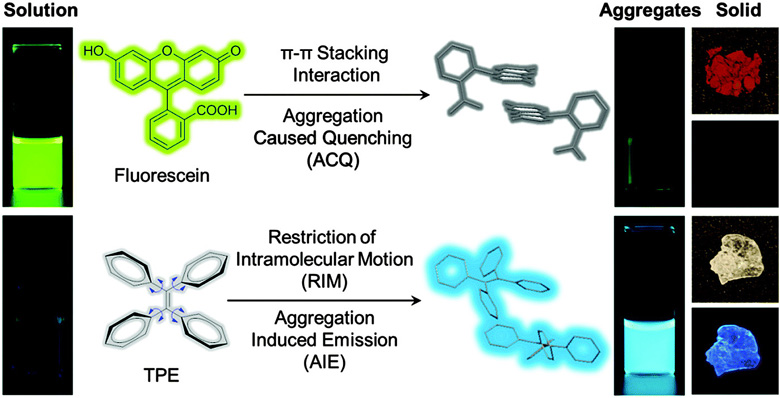
大部分的常用荧光生色团化合物(如荧光素)在溶液状态下是强发射体。然而,由于 π-π 堆积作用,其荧光发射在聚集状态或固态下被淬灭。如四苯基乙烯 (TPE) 这样的AIE 生色团呈螺旋桨形,在形成聚集体时就会发射荧光。固态的 TPE 能发射很强的荧光。Mater. Horiz., 2016, 3, 283-293
得益于 AIE 现象的发现,传统 NIR 荧光生色团在生物成像时的 ACQ 问题有了一个完美的解决方案。AIE 荧光生色团(AIEgens)在稀溶液状态时是没有荧光发射的,但在聚集状态下表现出强烈的荧光。因此,无论溶液的浓度有多高,AIEgens 都可以作为荧光探针来实现生物传感和成像方面的应用。
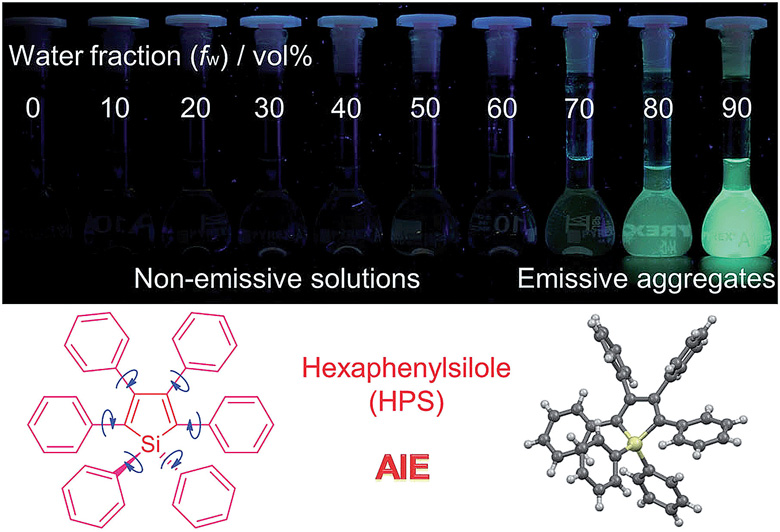
在溶液状态下,HPS 分子外围的苯环可以通过单键绕中心的噻咯自由旋转,这个过程以非辐射的形式消耗了激发态的能量,导致荧光减弱甚至不发光。在聚集状态下,HPS 分子的“螺旋桨”式构型可以防止 π-π 堆积,抑制荧光猝灭;同时由于空间限制,HPS 分子内旋转受到了很大阻碍,这种分子内旋转受限抑制了激发态的非辐射衰变渠道,打开了辐射衰变渠道,从而使荧光增强。Chem. Sci., 2015, 6, 5347-5365
在目前阶段,近红外波长的 AIEgens(NIR AIEgen)的发展还较为有限,仅有少量的高性能 NIR AIEgen 见于报道并被用于生物学研究。另外,迄今为止尚未见水溶性 NIR AIEgens 的报道。考虑到生物学研究是在生理环境(或水性介质)中进行的,水溶性 AIEgens 在这方面就会有很大的优势。因此,开发具有良好水溶性的 NIR AIEgens 仍然是一项重要且具有挑战性的工作。
细胞膜荧光成像不简单
细胞膜参与各种细胞过程和生物功能,如细胞信号传导、细胞粘附、内吞、胞吐和物质的选择性渗透等;因此,细胞膜对细胞来说不可或缺,而通过对细胞膜进行观察还可以得出与细胞状态和疾病相关的许多信息。鉴于此,应用荧光生物探针分子的细胞膜体外(in vitro)成像技术具有着重要的实际价值。

▲ 细胞膜的磷脂双层结构及膜蛋白的输运。Source: Membrane Transport @ Gfycat
然而,已有的细胞膜特异性荧光声色团(如 DiO、DiI、CellMask 等)都有一些缺点,比如发射波长短、斯托克斯位移小(Stokes shift,指最大荧光发射波长与最大吸收波长之间的差)、制备原液含有害的有机溶剂、需要较长的染色时间(incubation period)以及繁琐的染色后清洗操作,特别是后两者一直是细胞荧光成像领域长期未解的难题:
● 长时间的染色不仅费时,更经常会导致细胞组分的非特异性发光。
● 另一方面,染色之后残留的荧光探针分子依然能发出较强的荧光;为了提升细胞图像的信噪比,就需要在染色后将残留的荧光探针洗去。然而,这种洗脱过程不仅繁琐,而且容易改变细胞的周围环境并在清洗过程中造成细胞的丢失,更不能满足对生物过程进行连续监测的要求。
由此可见,能克服上述缺陷的新型细胞质膜荧光探针的开发,具有非常迫切的现实意义。
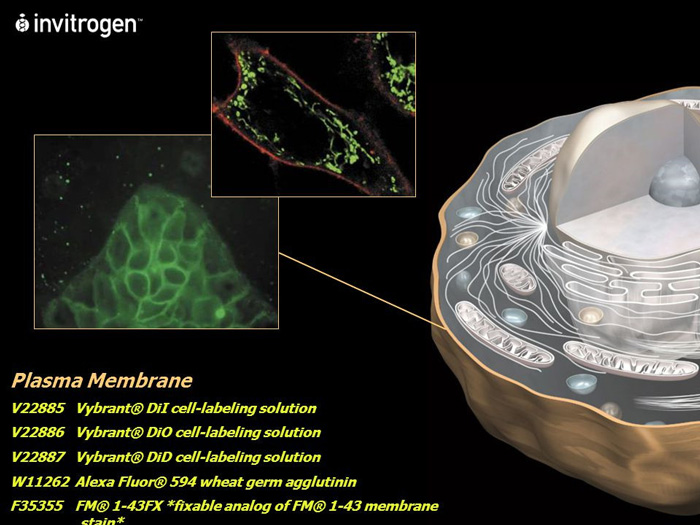
▲ 细胞膜荧光显像示意图。Source: Invitrogen
本篇论文
本文中首次报道了一种具有聚集诱导发光(AIE)特性的、最大发射波长在近红外区波段(NIR)的水溶性 AIE 生色团(AIEgen)的设计与合成工作。此 AIEgen 被命名为 TTVP,可以特异性地以细胞膜为靶标进行快速的『荧光染色』,无需洗脱操作即可清晰成像。此外,在可见光的照射下,TTVP 成功实现了癌细胞的光动力杀灭。

合成与表征
在本文报道的工作中,研究人员设计的 TVP 和 TTVP 这两个分子都是 D-A 型的化合物,其中 D 代表电子给体单元,A 代表电子受体单元。两者的合成路线如下图所示。
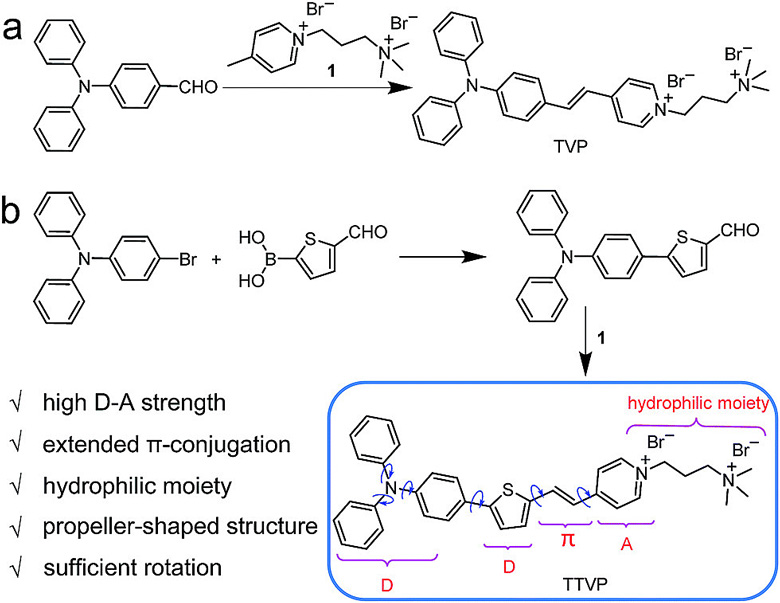
▲ TVP 和 TTVP 分子的合成与设计思路
这两个分子均包含三苯胺片段(作为 D)或 / 和噻吩片段(作为 D 和 π-桥)、碳-碳双键(π 桥)和吡啶盐片段(作为 A)。在这两个结构中,电子给体-受体(D-A)间有着强烈的相互作用,加上延伸后的 π 共轭体系,从而促进了分子内的电荷转移,因此实现了更低的电子带隙以及更长的吸收和发射波长。
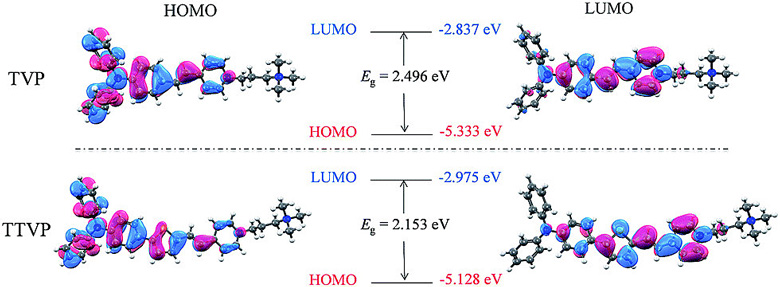
▲ TVP 和 TTVP 分子的 HOMO 和 LUMO 轨道
通过将电子供体-受体(D-A)结构片段和亲水性片段组合成螺旋桨形状的分子结构,就可以得到水溶性的 NIR AIE 生色团(TTVP 分子)。得益于亲水性的吡啶盐与铵盐片段,TVP 和 TTVP 分子都具有很好的水溶性。
这两个分子在纯的水溶液中几乎不发光,这是因为分子中存在着许多可以自由旋转的基团;这些基团的自由旋转以非辐射的形式消耗了激发态的能量,因此不发光。
在水和四氢呋喃 (THF) 的混合溶液中,随着 THF 比例的增加,TVP 和 TTVP 逐渐聚集并形成纳米尺度的聚集体,而溶液受激发后发出的荧光也随之逐渐增强。这是因为在聚集状态下,上述单键的自由旋转受到了限制;同时,三苯胺片段的扭曲构像进一步增加了分子间的距离,抑制了通过分子间 π-π 相互作用导致的荧光淬灭。
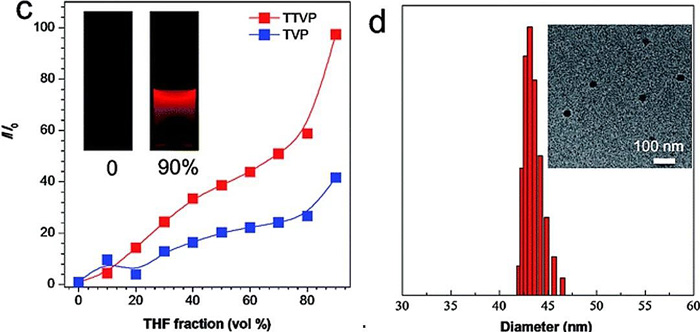
(c)THF/H2O 中不同 THF 比例所对应的聚集诱导荧光强度;(d)THF/H2O 中形成的纳米尺度聚集体粒径分布与电镜图像(TTVP)。
当 THF 的比例高达 90% 时,荧光强度也达到了最强。TVP 和 TTVP 两者的最大吸收波长则分别为 467 nm 和 480 nm,而两者在聚集状态下的最大荧光发射波长分别为 629 nm 和 708 nm(分别处在红光 / 近红外波段的附近),表现出较大的斯托克斯位移。
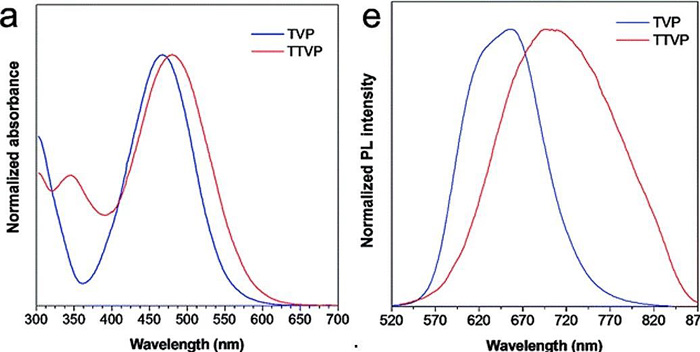
(a)TVP 和 TTVP 的吸收光谱;(e)TVP和 TTVP 的光致发光(PL)光谱。
生物成像应用
研究人员使用人宫颈癌细胞系(HeLa cells)进行了 TTVP AIEgen 的细胞膜的实际成像研究。作为水溶性的 NIR AIEgen,TTVP 在水溶液环境下不发射荧光(处于 off 状态),因此未染色细胞膜的残留 TTVP 几乎不会构成背景干扰。
不同条件下的成像效果如下图所示,细胞质膜成像非常清晰(与背景的对比度很高),而且在 10 min、5 min、2 min、30 s、3 s 的『染色』时长下,以及在脱洗或不脱洗的情况下,成像结果都没有明显的差异。

▲ 用 TTVP 染色 HeLa 细胞后的共聚焦显微镜图像(TTVP 染色液浓度 500nM,λex= 488 nm,1% 激光功率)
有理由相信,TTVP 染色细胞膜的能力源于其所带的正电荷以及所具有的两亲性:其上的正电荷使其通过静电相互作用与细胞膜结合(特别是通常带负电的癌细胞细胞膜);由于良好的亲水性,TTVP 在短时间内也不会穿透磷脂双层的疏水区域。另一方面, TTVP 的疏水性发光部分被嵌入到低极性低的疏水区域中,其上单键的转动受到限制,满足了 AIE 过程对分子内旋转受限的要求,从而在受到光照后就能发射出荧光。
▲ TTVP 作用下的 HeLa 细胞膜荧光成像:原理示意图
受到以上成功的鼓舞,本文作者将这种超快染色和无洗涤操作的 TTVP 细胞膜成像方法进一步拓展到了其它的细胞系中,包括 293T cells、HCC827 cells、HCT116 cells 和 MDCK2 cells。在所有的例子中,细胞膜的成像效果都令人满意:非常高的信噪比和非常强烈的红色荧光)。
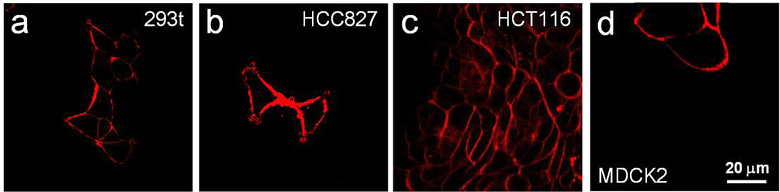
▲ 其它类型细胞的细胞质膜成像
光动力治疗上的应用
光动力治疗(photodynamic therapy, PDT)是一种温和的癌症治疗方法,对正常组织的创伤性极小且可精确控制,现已被批准用于临床。相比于紫外线,可见光对生物体系的伤害也更小。另一方面,先前报道过的各种细胞质膜荧光染料基本上只能用作成像探针,而不能同时实现成像和治疗的双重应用。

▲ 两种 Ru 化合物及其在 PDT 中的应用,Chem. Sci., 2018, 9, 502-512(南京工大赵强、黄维,中南民族大学李襄宏等)
鉴于 TTVP 在可见光区域的强烈吸收,所以可以考虑以可见光为激发光源,依托 TTVP 生成 ROS(活性氧物种,会对细胞造成伤害)的过程进行 PDT。
实验时,研究人员利用指示剂 H2DCF-DA 来测量的 TTVP 受光照后的 ROS 生成效率。如下图 a 所示,无光照,TTVP 和 H2DCF-DA 单独存在是荧光发射极弱。相反,在 TTVP 存在的情况下,H2DCF-DA 的荧光发射强度随着白光光照时间的增加而逐渐增强,在 60 秒内增长了 87 倍。
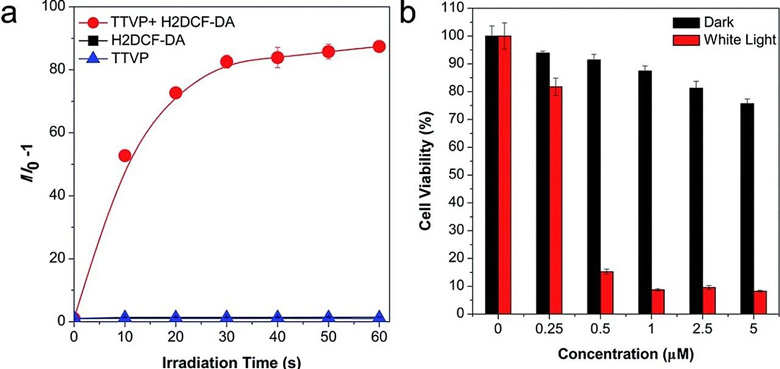
(a)不同照射时间后的 H2DCF-DA 发射荧光强度,表明了 TTVP 可在光照下产生 ROS;(b)不同照射时间后的细胞活性测试结果,表明了 TTVP 被光照后所产生的 ROS 可对癌细胞进行杀灭。
研究人员利用细胞存活率分析手段(MTT assay),在 HeLa 细胞上进行了定量评估,表明了 TTVP 在 PDT 应用上的巨大潜力。在 500 nM 的 TTVP 浓度下,HeLa 细胞的活性在光照 10 min 后迅速下降至最初的 15%;在 1 μM 的 TTVP 浓度下,白光照射后 HeLa 细胞几乎完全死亡(上图 b)。与之形成鲜明对比的是,在黑暗条件下,HeLa 细胞在 1 μM TTVP存在条件下依然保持 90% 的活性。
体内成像与细胞毒性试验
如下图所示,在小鼠的 HeLa 肿瘤内注射了 TTVP 水溶液后可以得到非常清晰的肿瘤成像。为了评估TTVP的肿瘤滞留潜力,注射后连续实时成像观察,注射后 24 小时,肿瘤荧光图像依然清晰可辨,表明 TTVP 在肿瘤细胞中具备优异的滞留能力;一般水溶性荧光小分子会很快被代谢排出,本文报道的水溶性TTVP 可以持久稳定地嵌入在肿瘤细胞的细胞膜种,有利于提高其肿瘤滞留能力,有望用于活体肿瘤的持久成像和治疗。
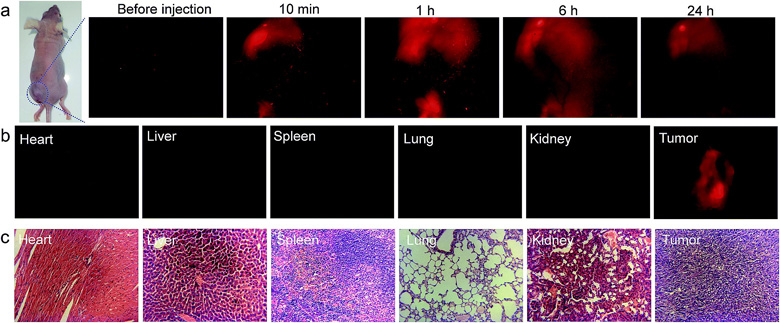
▲ 应用体内成像与细胞毒性试验(器官显像与组织切片)
此外,瘤内注射 TTVP 24 h 后,H&E 染色(苏木精-伊红染色)后的器官切片图像显示,小鼠的主要器官并没有出现明显的病理学改变,没有出现系统性毒性的迹象。
小结
最后,作者指出,该项研究为设计具有长发射波长的水溶性 AIEgens 提供了新的思路,推动了高效且易于操作的新型荧光生物探针的开发进程。这项研究结果还能帮助发展出更高效的光动力治疗分子,不仅有利于肿瘤的治疗,还能促进生物探针在光动力治疗的应用。
唐本忠院士简介

唐本忠 院士 香港科技大学
唐本忠,中国科学院院士,香港科技大学张鉴泉理学教授、化学系与生物医学工程系讲座教授,华南理工大学-香港科技大学联合研究院院长。1957 年出生于湖北省潜江市;1982 年于华南理工大学获学士学位,1985 年、1988 年先后获日本京都大学硕士、博士学位;曾在多伦多大学从事博士后研究工作。1994 年加盟香港科技大学,2009 年增选为中国科学院院士,2013 年入选英国皇家化学会 Fellow,2015 年在华南理工大学人体组织功能重建国家工程技术研究中心支持下获批香港分中心,并任主任一职。现为科技部 973 计划项目首席科学家、国家自然科学基金基础科学研究中心项目负责人、广东省引进创新科研团队带头人、华南理工大学发光材料与器件国家重点实验室学术委员会主任,以及中国化学会和英国皇家化学会联合期刊 Materials Chemistry Frontiers 主编。
唐本忠院士主要从事高分子化学和光电功能材料研究,在聚集诱导发光(Aggregation -Induced Emission, AIE)这一化学和材料前沿领域取得了原创性和引领性的研究成果。作为 AIE 概念的提出者和研究的引领者,唐本忠教授累计发表学术论文约 1000 篇,引用 50000 余次,h-指数为 112,并于 2014-2017 年连续入选化学和材料双领域高被引用科学家。
同时,唐本忠教授先后获得多项荣誉及奖励,如国家自然科学一等奖(2017,第一完成人)、何梁何利科学与技术进步奖(2017)、第 27 届夸瑞兹密国际科学奖(2014)、美国化学会高分子学术报告奖(2012)、国家自然科学二等奖(2007,第四完成人)、裘槎高级研究成就奖(2007)、中国化学会高分子基础研究王葆仁奖(2007)和爱思唯尔出版社冯新德聚合物奖(2007)等。
本文第一作者为香港科技大学、深圳大学AIE研究中心王东博士。
(本文已获RSC授权)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号