北大焦宁团队Science:硝基甲烷变氮源,替代叠氮“施密特”
在2016年JMC发表的一篇综述里,作者统计了从1978年到2014年药物研发中常见的化学反应,其中酰胺合成出现的频率最高,并且呈逐年上升趋势(J. Med. Chem., 2016, 59, 4443)。酰胺之外,腈类化合物在药物研发领域也十分重要。酰胺和腈类化合物还在合成材料、农用化学品等领域受到研究人员的重视,因此,这两类化合物的制备是化学家研究的热点。合成酰胺和腈最常见最经典的方法非施密特反应(Schmidt reaction)莫属了。早在1923年,K. F. Schmidt就发现二苯甲酮在叠氮酸和硫酸中加热能定量产生苯甲酰苯胺。不过,易爆炸、剧毒的叠氮化物并不是一种对操作者太友好的试剂,化学家们也一直在尝试寻找替代品,但目前仍无太大进展。虽然Beckmann重排也能制备二级酰胺(无法制备伯酰胺),但常常需要超过130 ℃的高温和强酸条件或羟基的预活化(如通过甲苯磺酸化),底物兼容性很受限制,而且经典Beckmann条件下几乎不能实现醛肟转化为相应的腈以及N-未取代的酰胺。
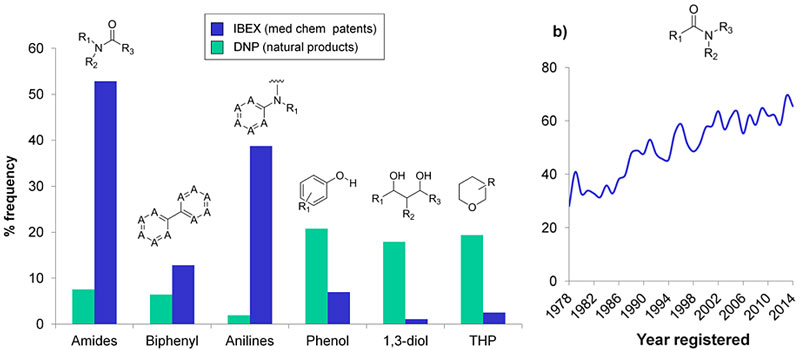
药物中出现频率较高的基团。图片来源:J. Med. Chem.
在这种背景下,如果能找到一种廉价易得且性质温和的叠氮化物替代品,无疑会对Schmidt重排这样的反应甚至化学合成工业产生深远影响。很显然,硝基甲烷是一种相对安全且廉价的大宗化工原料,由于硝基的强吸电子作用使其可作为碳亲核试剂应用在Henry反应、交叉脱氢偶联(CDC)反应和Michael加成等反应中构筑C-C键(下图)。相比之下硝基甲烷作为氮供体却鲜有报道,目前为止只有Nef反应过程中涉及亲电的硝酰基(HNO),可惜由于快速的二聚化(k = 8×106 M-1s-1)产生惰性的N2O和被O2氧化(k = 3×103 M-1s-1)导致其相当不稳定,从而限制了其广泛的应用。
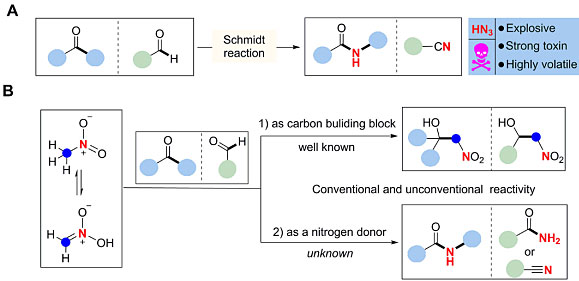
经典的Schmidt反应和硝基甲烷应用。图片来源:Science
在方法学研究中,对于不稳定的物种(如醛)常常采用的操作是将其还原为相对稳定的衍生物。如果将不稳定的亲电活性物种HNO还原成稳定的羟胺衍生物(NH2OR),那么后者或许可通过Beckmann重排过程将酮转化为酰胺。这似乎可以用硝基甲烷替代叠氮化物进行各种Schmidt反应?其实不然,各位读者别忘了,前文我们提到目前Beckmann重排尚不能应用在醛上,也就是说用醛合成伯酰胺或腈是相当困难的。近日,北京大学的焦宁教授(点击查看介绍)课题组在这方面研究实现了重大突破,发展了一种以硝基甲烷为亲电氮供体的方法,能使醛、酮、炔烃甚至简单的烷基苯发生Schmidt反应转化为相应的酰胺或腈。该方法的关键在于对硝基甲烷的级联活化策略(cascade activation strategy, CAS):硝基甲烷经过三氟甲磺酸酐的第一次活化发生C-N键断裂,随后再经过甲酸/乙酸的第二次活化,N=O键还原,得到一种新型稳定的氮源,用于后续酰胺及腈类化合物的合成。该反应底物适用性广,反应条件相对温和,具体工作发表在Science 上,第一作者为刘建忠博士。
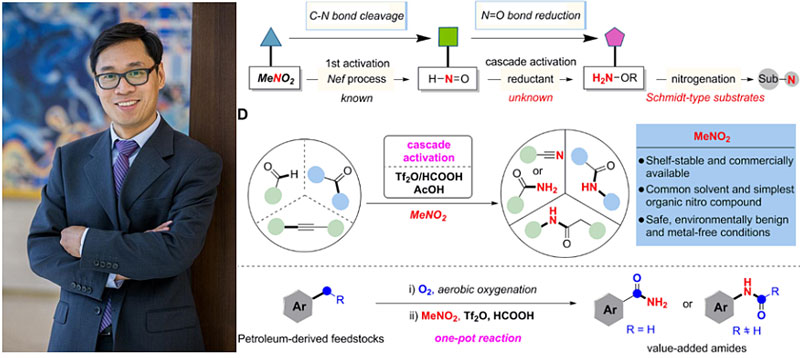
焦宁教授和本研究工作。图片来源:北京大学药学院 [1] 和Science
研究人员首先以乙酰苯类化合物作为底物进行研究,通过大量的条件筛选发现硝基甲烷(4.0 equiv.)在三氟甲磺酸酐(2.0 equiv.)和甲酸(2.5 equiv.)作用下可以定量地被活化(NMR检测到相应量的副产物三氟甲磺酸和甲醛)(下图A),能够将底物(S1)转化相应的目标产物。随后,研究人员考察了乙酰苯的底物范围,各种取代基如卤素、氨基、羟基、醚和硫醚等都可以兼容该反应,以中等至较高的收率得到目标产物。对于不对称的二芳基酮,富电子的芳环比缺电子的芳环更易迁移;而三烷基取代的乙酰苯(S26)则发生脱烷基化反应生成苯甲酰胺,收率为78%。

乙酰酮底物的转化。图片来源:Science
接下来,研究人员对醛类底物进行了考察(下图),醛在此条件下则很顺利的转化为伯酰胺,这就大大突破了Beckmann重排的限制。由于在此转化中检测到少量的苯甲腈,研究人员认为适当的Lewis酸也许能促进肟中间体转化为腈。经过研究发现,在Lewis酸Fe(OTf)3(0.1 equiv.)和碱三乙胺(2.0 equiv.)的协同作用下,有利于肟的消除形成腈。脂肪族醛(80)和(杂)芳香醛(60-79)均具有良好的耐受性,以中等至较高的收率得到目标产物,并且苯环上的硝基(53、66、71)并不受影响。
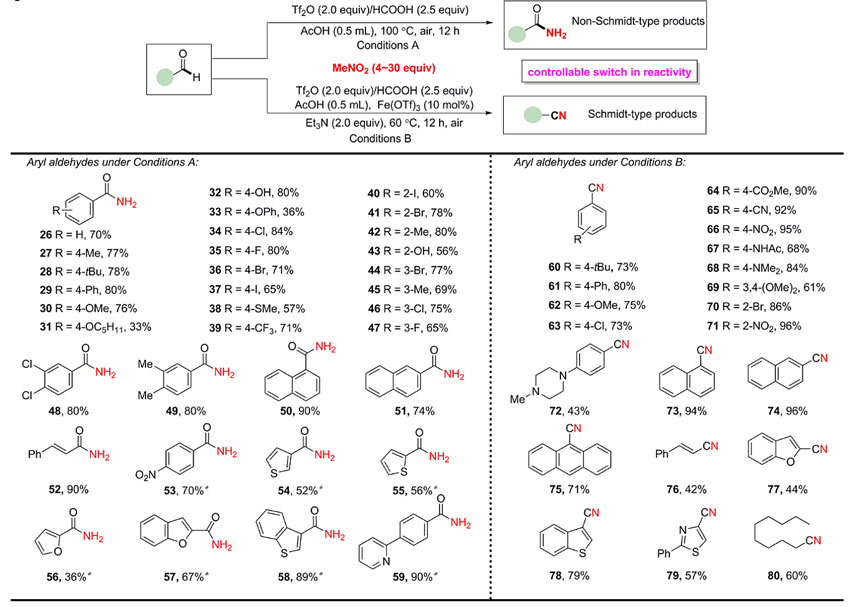
醛的转化。图片来源:Science
紧接着,研究人员将底物范围进行了更广的拓展。在同样的条件下,端炔或非端炔可经水合作用转化为酮中间体(IR证实)进而转化为相应的链状或环状酰胺。末端炔烃类底物具有较好的兼容性,而对于不对称非末端炔烃,则以高选择性得到了相应的N-芳基酰胺(85-87、90-92)。此外,对于大宗商品化合物诸如烷基取代的芳烃,可以先通过Co/NHPI/O2氧化体系原位生成相应的酮或醛,接着加入硝基甲烷一锅法转化为相应的N-取代酰胺或伯酰胺,该串联反应不需要分离纯化酮或醛中间体,且氧化体系环境友好,具有很高的工业化应用前景。另外,研究人员还将上述反应条件应用在多种药物分子(96-111)的后期修饰上,都能很好地进行转化,成为附加值较高的酰胺。当Hock反应的原料——异丙苯(工业上生产苯酚)在该条件下进行反应时,能够以克级规模通过β-裂解得到相应的酰胺产物2,产率为50%(下图D)。环己基苯也能够发生该反应生成酰胺114,通过一步转化为尼龙6.6前体己二酸(115)和苯胺(116)(下图D)。环己酮也可以在该反应条件下以克级规模一步法高效合成尼龙6的单体——ε-己内酰胺(CPL),且可以直接重结晶得到产物,无需柱层析分离。此外,该方法也能够以较高的收率制备颇具挑战的大环内酰胺84,对于长链脂族酮120和环庚酮122也能够实现该转化。
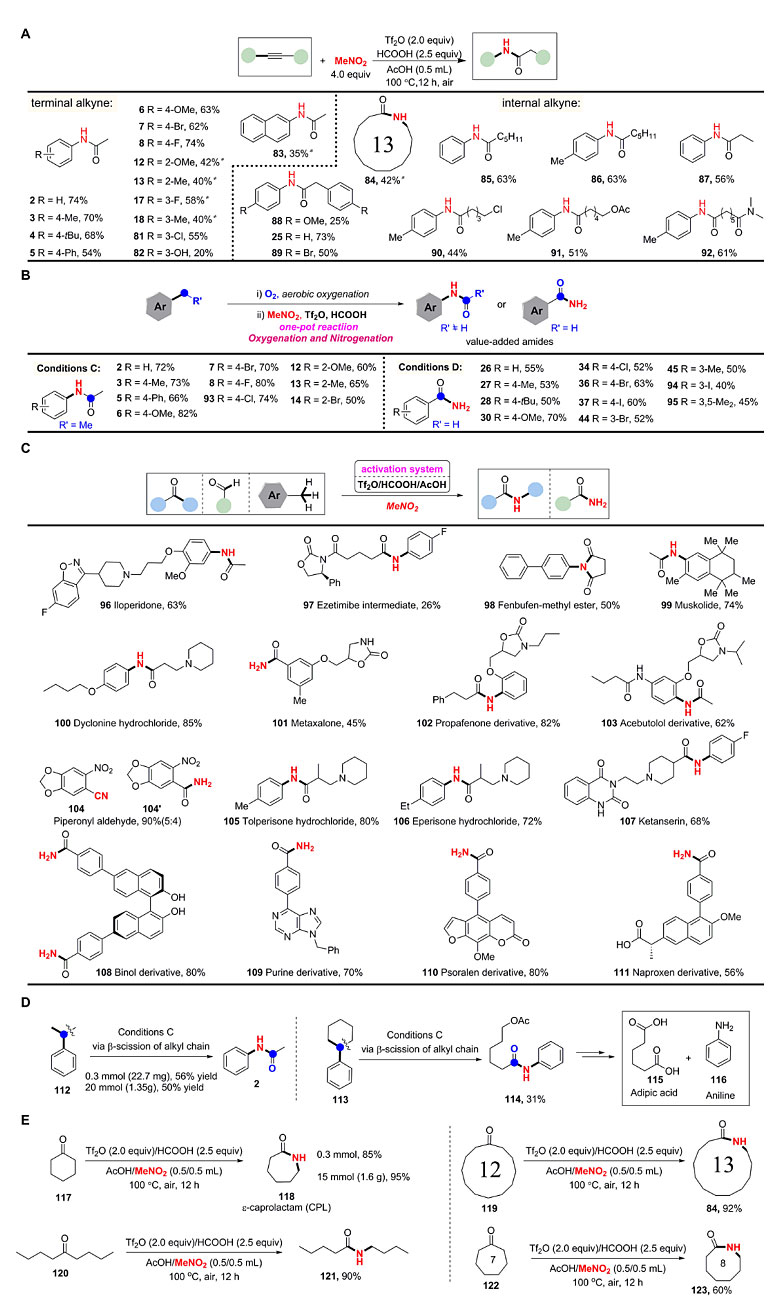
其他合成应用。图片来源:Science
之前在拓展底物过程中已经发现在该条件下苯环上的硝基不受影响,机理研究表明当用硝基苯取代硝基甲烷时,反应不能进行(下图A),并且硝基叔丁烷和硝基异丙烷相对于硝基甲烷效果很差,而硝基乙烷则与硝基甲烷效果差不多,这些事实暗示硝基在整个转化中可能与相连的烷基存在某种紧密的关系(可能是互变异构)。果然,检测到的动力学同位素效应(KIE)为3.6,表明硝基甲烷上C-H键断裂是该转化的决速步。高分辨质谱(HRMS)检测到反应中确实存在乙酰羟胺(NH2OAc)中间体及其盐(NH2OAc•HOTf),进一步的对照实验则表明这些中间体可能是该反应中真正的氮源供体,同时也说明醋酸不仅仅作为反应的溶剂而且也参与了反应。参考Nef反应的机理,研究人员提出了该反应的机理(下图C):硝基甲烷首先发生互变异构,被三氟甲磺酸酐活化形成高亲电性物种II,之后与水进行加成形成半缩醛III,接着通过分子内C-N键断裂形成IV并释放出HCHO,然后消除一分子TfOH形成高氧化性物种HNO(V),随后被甲酸还原成真正的氮源供体——羟胺VI (NH2OAc•HOTf或 NH2OAc),其中使用中等还原性的HCOOH,可以抑制活性物种HNO(V)的过度还原。最后,与酮进行加成得到相应的肟VII,接着发生快速Beckmann-type重排得到最终产物酰胺或腈。
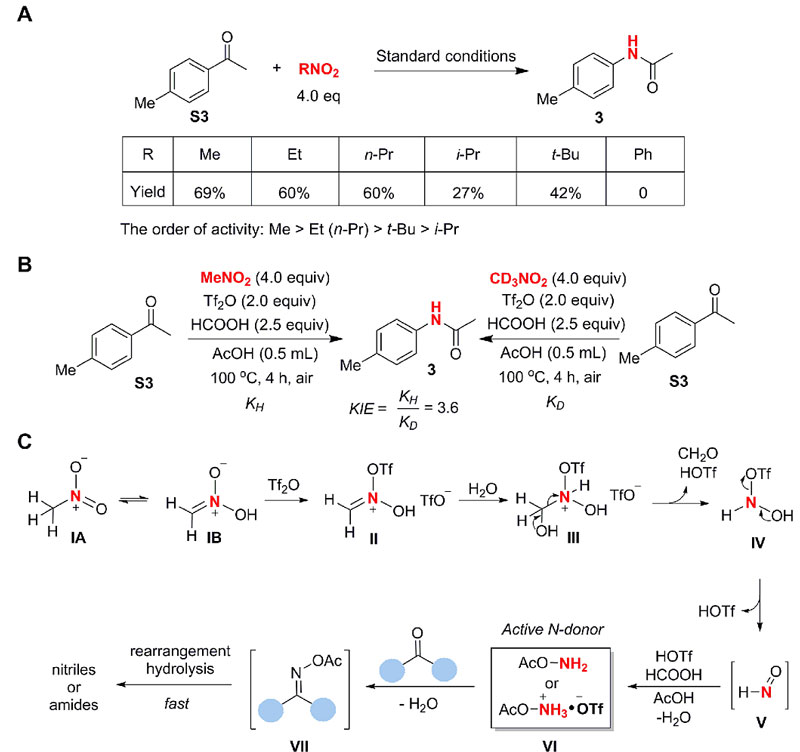
机理研究。图片来源:Science
总结
纵观焦宁教授课题组的文章,可以发现近年来他们一致致力于碳氢化合物的“氮化”方面的研究并取得了一系列创造性的研究成果。在本工作中,他们巧妙地利用“级联活化策略”,将原本作为溶剂及亲核碳源的硝基甲烷转变为新型亲电氮化试剂,替代危险的叠氮化物将醛、酮、炔烃甚至烷基取代的芳烃转化为具有重要价值的酰胺或腈类化合物,使近百岁的Schmidt反应“老树开新花”,无疑是一项极具突破性的研究。小编读罢佩服之余尚有些许期待,如果能将昂贵的三氟甲磺酸酐替换成更廉价的活化试剂,那么该反应无疑会更完美。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Nitromethane as a nitrogen donor in Schmidt-type formation of amides and nitriles
Jianzhong Liu, Cheng Zhang, Ziyao Zhang, Xiaojin Wen, Xiaodong Dou, Jialiang Wei, Xu Qiu, Song Song, Ning Jiao
Science, 2019, DOI: 10.1126/science.aay9501
导师介绍
焦宁
https://www.x-mol.com/university/faculty/26819
参考文献:
1. 北京大学药学院官网报道:
http://sps.bjmu.edu.cn/xyxw/208509.htm
(本文由峰千朵供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号