手性卤键轮烷对二羧酸阴离子的选择性识别
广泛存在的二羧酸阴离子(DC2-)参与多种重要的生命活动过程,捕获及识别它们对于研究与其相关的生命活动至关重要。不过,这些二羧酸阴离子具有很多理化性质相似的顺反异构体和对映异构体,进行选择性地识别是非常具有挑战的课题。轮烷作为一类具有机械互锁结构的超分子,在结合识别阴离子的领域有着重要的应用。
近年来,卤键作为能高效识别阴离子的超分子相互作用而备受关注。英国牛津大学的Paul Beer教授(点击查看介绍)研究团队最近在Angew. Chem. Int. Ed. 上发表文章,通过手性卤键[3]轮烷主体分子与二羧酸阴离子形成三明治形复合物,完成了对二羧酸阴离子顺反异构体和对映异构体的选择性识别。
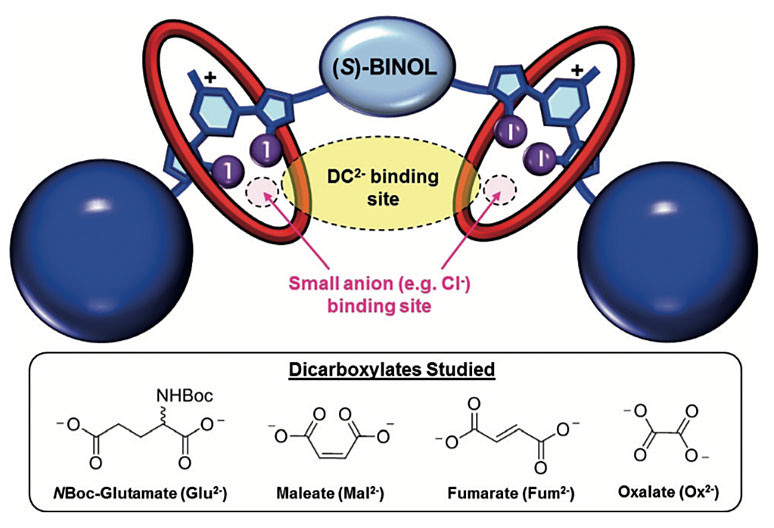
图1. [3]轮烷主体的设计以及二羧酸阴离子。图片来源:Angew. Chem. Int. Ed.
[3]轮烷主体分子的设计思路如图1所示。通过(S)-1,1'-联-2-萘酚((S)-BINOL)荧光团连接两个卤键供体——3,5-二碘代吡啶鎓单元,构成轴结构,其上通过机械键“套入”两个大环,由此形成[3]轮烷分子。[3]轮烷分子中的大环与吡啶鎓单元形成强供体-受体芳香性π-π堆积相互作用,构成了二羧酸阴离子结合口袋。结合二羧酸阴离子会导致[3]轮烷分子荧光变化,这种响应是二羧酸阴离子顺反异构体和对映异构体选择性识别的基础。
作者以氯离子模板合成策略合成了[3]轮烷4.(PF6)2(图2),总产率为37%。
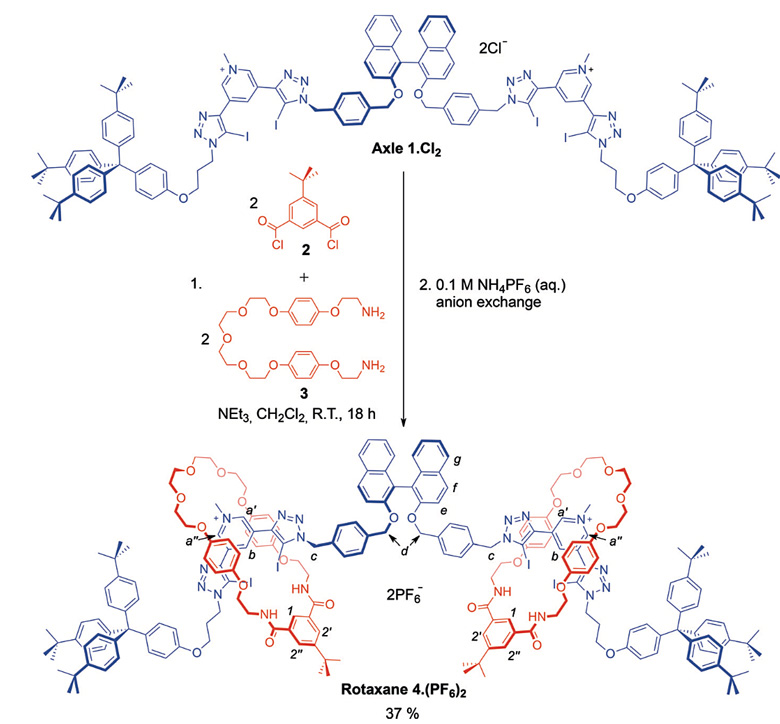
图2. 氯离子模板合成[3]轮烷。图片来源:Angew. Chem. Int. Ed.
作者通过1H NMR滴定实验比较了4.(PF6)2对(S)-谷氨酸阴离子((S)-Glu2-)和氯离子的结合性质。通过大环和吡啶鎓单元的质子化学位移以及其与滴定量的关系,确定了(S)-谷氨酸阴离子与轮烷形成了1:1的复合物(图3)。与之相对,氯离子可以与每个大环形成1:1的复合物。这说明,(S)-谷氨酸阴离子可能因为太大而不能进入每个大环内的互锁结合位点,而是与两个大环之间的结合口袋形成结合。(R)-谷氨酸阴离子((R)-Glu2-)、富马酸阴离子(Fum2-)和马来酸阴离子(Mal2-)也在1H NMR滴定实验中显示出了类似结果。
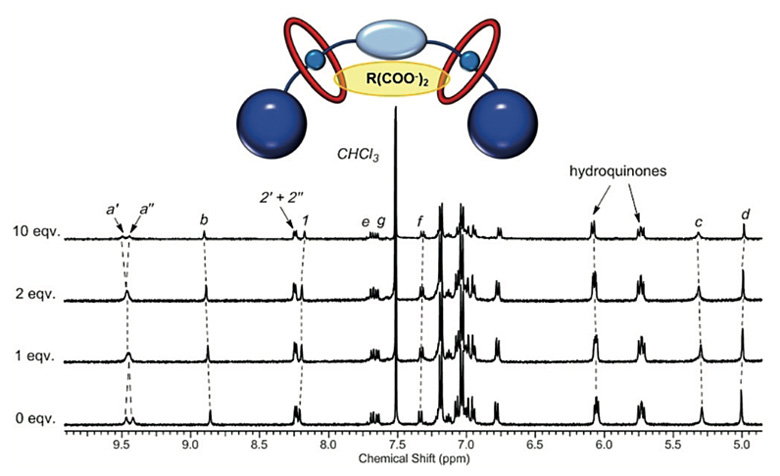
图3. [3]轮烷分子和(S)-谷氨酸阴离子的1H NMR滴定实验。图片来源:Angew. Chem. Int. Ed.
作者通过进一步的荧光滴定实验,发现富马酸阴离子可以引起明显的(S)-BINOL荧光淬灭。相比之下,氯离子和较小的草酸阴离子(Ox2-)引起的变化要小得多(图4)。通过分析荧光滴定实验的数据,作者得到了二羧酸阴离子与轮烷形成复合物的结合常数,其结果如表1所示。

图4. [3]轮烷分子和富马酸阴离子及氯离子的荧光滴定实验。图片来源:Angew. Chem. Int. Ed.
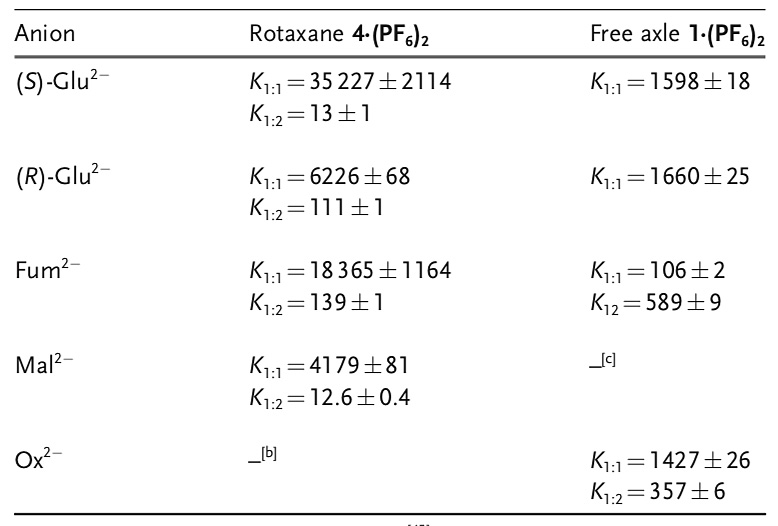
表1. 二羧酸阴离子与轮烷形成复合物的结合常数。图片来源:Angew. Chem. Int. Ed.
可见,[3]轮烷4.(PF6)2对(S)-与(R)-谷氨酸阴离子这一组R/S异构体的选择性达到5.7倍,而对富马酸阴离子与马来酸阴离子这一组顺反异构体的选择性达到4.4倍。相比之下,[3]轮烷4.(PF6)2的前体手性轴1.(PF6)2对R/S是几乎无选择性的,并且其对草酸阴离子有一定的结合能力,这说明了形成轮烷的超分子结构是二羧酸阴离子选择性识别的关键。随后,作者还进行了分子动力学模拟来研究[3]轮烷分子对二羧酸阴离子的结合,结果也印证了形成轮烷结构对二羧酸阴离子结合和选择性识别的重要性。
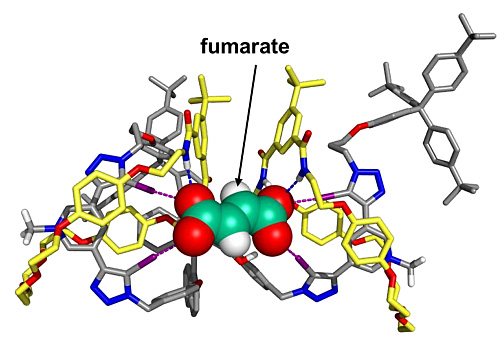
图5. [3]轮烷分子和富马酸阴离子结合的分子动力学模拟。图片来源:Angew. Chem. Int. Ed.
综上,Paul Beer教授研究团队首次报道了以手性卤键轮烷为主体与常见二羧酸阴离子形成三明治形复合物,完成了对二羧酸阴离子顺反异构体和对映异构体的选择性识别。这一成果有望应用于分析及纳米技术领域。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A Chiral Halogen‐Bonding [3]Rotaxane for the Recognition and Sensing of Biologically Relevant Dicarboxylate Anions
Angew. Chem. Int. Ed., 2018, 57, 584-588, DOI: 10.1002/anie.201711176
导师介绍
Paul Beer
http://www.x-mol.com/university/faculty/2610
(本文由PhillyEM供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
















































 京公网安备 11010802027423号
京公网安备 11010802027423号