从炔丙醇到四取代轴手性联烯
轴手性联烯是一类优势骨架,存在于诸多的天然产物、药物分子以及先进功能材料分子结构中,也是有机合成中非常实用的合成前体、配体以及催化剂。因此,发展高效构建手性联烯尤其是多取代手性联烯化合物的合成方法长期以来一直是有机合成领域的研究热点。
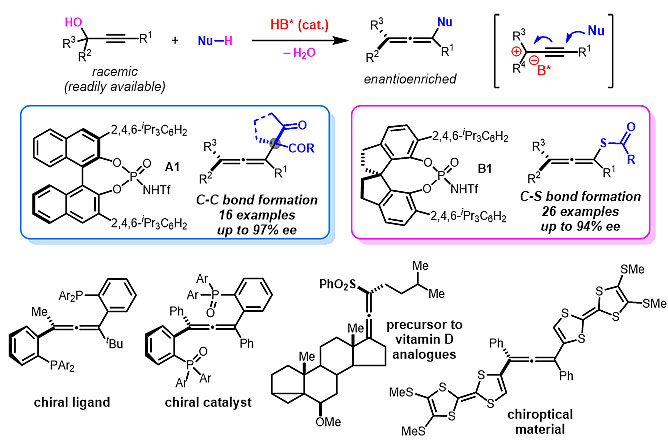
最近,香港科技大学的孙建伟(点击查看介绍)团队与林振阳(点击查看介绍)团队合作,首次利用简单易得的炔丙醇作为底物,在手性Brønsted酸(HB*)催化下与1,3-二羰基化合物、硫代乙酸类亲核试剂发生反应构建四取代轴手性联烯,高收率、高非映选择性及高对映选择性地合成了目标分子。该方法可以同时构建具有挑战性的轴手性及季碳连续手性中心,反应条件温和,操作简单,无需严格无水无氧处理,水作为唯一副产物。特别地是,先前的方法主要集中于二取代和三取代轴手性联烯的合成上,而关于四取代以及杂原子取代轴手性联烯的合成鲜有报道。
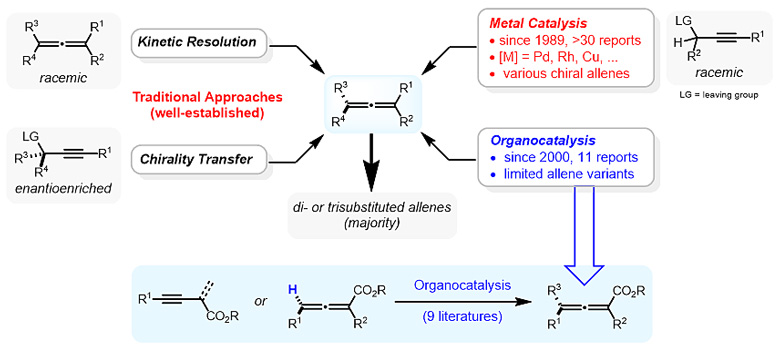
以往报道的合成手性联烯化合物的方法主要包括:1)手性拆分消旋联烯化合物;2)手性转移光学纯炔丙醇及其衍生物;3)过渡金属催化构建手性联烯。近三十年以来,为了避免繁琐的拆分过程以及预先制备手性原料,过渡金属(Pd, Rh, Cu等)催化构建手性联烯的方法得到了很好的发展。相比之下,通过有机分子催化对映选择性合成轴手性联烯的研究却非常有限,反应模式也相对单一,绝大多数反应依赖于不饱和烃的去质子化及质子化过程实现轴手性构建。
考虑到炔丙醇本身是一类高效的合成子,作者基于手性阴阳离子对的概念,巧妙地利用炔丙醇在酸性条件下脱水的实验过程,引入手性阴离子,从而实现对亲核试剂进攻的选择性调控,构建轴手性。经过大量的实验探索,作者最终发现在具有较强酸性的手性Brønsted酸A1和B1催化下,可以分别高效地实现手性联烯C−C和C−S键的形成。随后他们对底物适用性进行了研究,证明了该反应具有良好的底物普适性。

同时,他们对底物进行了一系列转化,成功拓展了四取代轴手性联烯的合成应用。

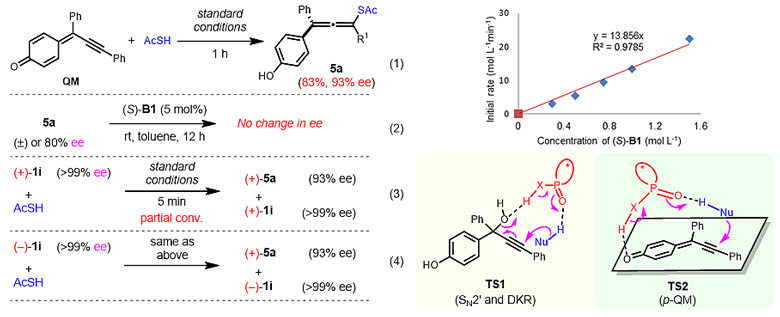
最后,作者进行了一系列的控制实验与机理研究。对于带有酚基的炔丙醇底物,共轭炔基醌酮化合物(QM)能够被分离得到,于标准条件下反应,可以得到与从炔丙醇出发制备手性联烯相同的结果,表明QM很有可能是反应的中间体。如果将产物(消旋或手性联烯)于催化剂存在条件下搅拌,可以监测到产物的ee值并不发生变化,说明反应过程是不可逆的。分别将光学纯的炔丙醇对映异构体于在标准条件下反应,监测得到同一联烯产物,且两炔丙醇对映异构体的手性保持不变,表明传统的SN2'反应路径(TS1,动态动力学拆分路径)在这一体系中不太可能。此外,动力学实验研究显示催化剂表现为一级动力学,说明反应过程中一分子催化剂足以促进反应的发生,理论计算也进一步支持这一实验结果。基于这些实验研究,作者推测反应除了经由炔丙基阳离子中间体参与的反应路径外,还很有可能是经由共轭炔基醌酮参与的1,8-共轭加成反应路径(TS2)。值得一提的是,由于不对称1,8-共轭加成的活化位点与手性诱导中心间具有较大距离,其不对称调控具有一定的挑战性,因此,目前高对映选择性1,8-共轭加成反应的成功案例只有少数几例报道。
——总结——
以手性Brønsted酸作为有机分子催化剂,通过活化炔丙醇底物实现了轴手性的四取代联烯以及杂原子取代联烯产物的构建,反应具有理想的收率与优秀的对映选择性。进一步研究发现,富电子芳基作为反应中重要的导向及活化基团可以促进炔丙基阳离子及共轭炔基醌酮中间体的形成,并在催化剂的引导下接受亲核试剂的进攻,即具有一定挑战性的1,8-共轭加成。该类反应为发展更为高效便捷的手性联烯合成策略提供了新的思路及借鉴。这一成果已于近期发表在Nature Communications 上,文章的第一作者是香港科技大学博士后钱德云。
该论文作者为:Deyun Qian, LinLin Wu, Zhenyang Lin, Jianwei Sun
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Organocatalytic synthesis of chiral tetrasubstituted allenes from racemic propargylic alcohols
Nat. Commun., 2017, 8, 567, DOI: 10.1038/s41467-017-00251-x
导师介绍
孙建伟
http://www.x-mol.com/university/faculty/7073
林振阳
http://www.x-mol.com/university/faculty/38301
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号