上转换X:大反斯托克斯位移的三重态-三重态湮灭上转换的构建与抗肿瘤药物的释放
光切断抗肿瘤药物的释放在近年来的研究中得到了广泛的关注。与传统的化疗药物相比,光切断抗肿瘤药物的释放具有许多优点,例如高时空分辨性、低生理副作用、高肿瘤药物利用率等。在目前的光切断基团中,其吸收主要集中在紫外区和深蓝区,很难实现动物模型中抗肿瘤药物的释放。在以往的研究中,人们开发出稀土掺杂的上转化纳米颗粒作为近红外光转化介质,实现了可控的抗肿瘤药物释放,然而稀土上转化纳米颗粒存在许多缺点,例如激发光功率大、上转化效率低,并且稀土元素存在不确定性的生理毒性。
为了解决目前稀土上转化中存在的问题,开发新类型的有机上转化体系(上转换X)非常重要。三重态-三重态湮灭上转化(TTA-UC)在近年来得到了广泛的研究,这类上转化体系激发光功率低、上转化效率高,调节给体和受体的组合可以有效调节上转化的激发波长和发射波长。在以往的研究中,人们开发出红光吸收的钯、铂卟啉大环光敏剂、苝作为受体的TTA-UC体系,但是这类上转化体系很难实现从远红区到深蓝区的上转化。为了实现在模型动物中光诱导的抗肿瘤药物释放,开发远红光到深蓝光区的上转化体系非常重要。
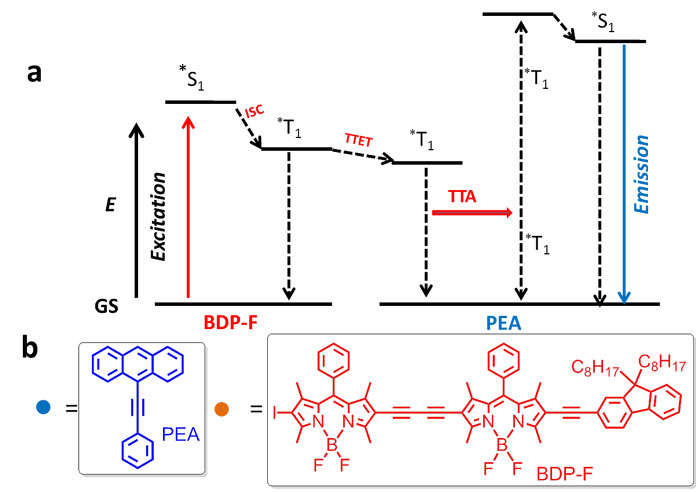
图1.(a)TTA-UC的机理;(b)光敏剂BDP-F和受体PEA的分子结构
氟硼吡咯(BODIPY)染料具有优良的性质,例如大摩尔消光系数吸收、良好的光稳定性、分子结构容易修饰以及低生理毒性等。麻省大学医学院的韩纲教授及其同事不仅设计了远红区强吸收的BODIPY光敏剂,而且发现9-乙炔基蒽作为受体时能够有效地实现从远红区到深蓝区的上转化,反斯托克斯位移为0.97 eV。结合香豆素作为光切断基团的抗肿瘤药物,作者构建了TTA-UC诱导的抗肿瘤药物纳米颗粒。实验测试发现,上转化发光能够有效被光切断基团吸收,从而使抗肿瘤药物得到释放。
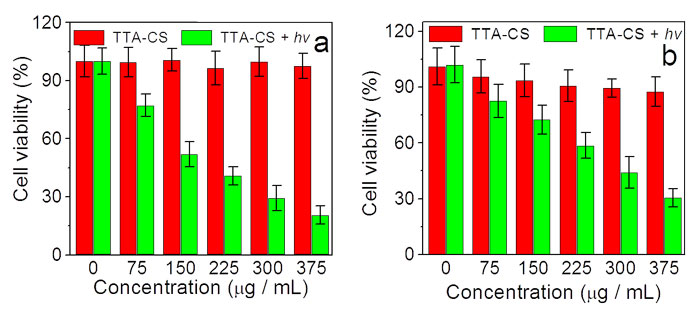
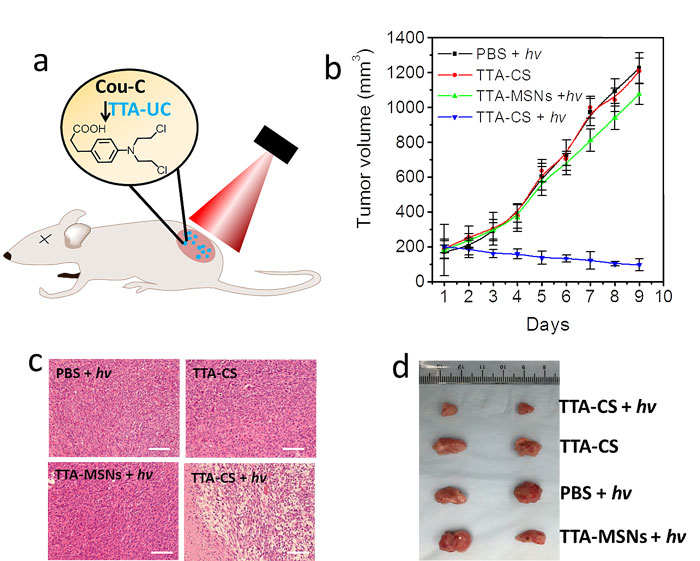
图2.(上)TTA-UC诱导的抗肿瘤药物对肿瘤细胞的抑制效果;(下)(a)TTA-UC诱导抗肿瘤药物释放的示意图;(b)肿瘤体积的大小;(c)不同实验条件下肿瘤的H&E染色切片;(d)不同实验条件下肿瘤体积的大小
作者将该纳米颗粒应用于肿瘤治疗,首先测试了该纳米颗粒对肿瘤细胞的抑制效果。实验发现,纳米颗粒在低功率远红光的照射下,能够有效抑制多个肿瘤细胞系,碘化吖啶染色进一步说明了其肿瘤抑制效果。随后他们将该纳米颗粒应用于模型小鼠动物的抗肿瘤治疗研究,与对照组相比,发现在远红外光LED的照射下,注射了纳米颗粒的小鼠肿瘤得到了有效的抑制。在治疗过程中,该纳米颗粒不会对小鼠的生长造成严重的影响。通过对主要器官的H&E切片分析,作者没有观察到主要器官的损伤。小鼠长时间的血液分析表明该纳米颗粒不会引起发炎症状。综上所述,TTA-UC纳米颗粒作为无重元素的新型光转化介质能够实现对抗肿瘤药物的精准释放,为肿瘤治疗提供了新的方法,在临床转化中具有很大的潜力。相关研究成果发表在Angew. Chem. Int. Ed 上。
该论文作者为:Ling Huang, Dr. Yang Zhao, He Zhang, Dr. Kai Huang, Jinyi Yang, Prof. Dr. Gang Han
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Expanding Anti-Stokes Shifting in Triplet–Triplet Annihilation Upconversion for In Vivo Anticancer Prodrug Activation
Angew. Chem. Int. Ed., 2017, 56, 14400, DOI: 10.1002/anie.201704430
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号