Cell丨上科大团队揭示GPCR多重药理学分子机制
本文获“BioArt”授权转载,版权归“BioArt”所有,任何转载需获得“BioArt”授权。
近几年来,以上海科技大学和中科院上海药物所为代表的国内研究机构屡次在GPCR领域取得重要进展,特别是去年5月份,Nature集中发表中国科学家多项GPCR重大成果(详见此前BioArt报道:Nature集中发表中国科学家多项GPCR重大成果),这标志着国内在该领域处于世界前列。
2018新年伊始,中科院上海药物所吴蓓丽研究组在揭示B型GPCR信号转导机制研究方面再次取得重要进展,该成果有望加速2型糖尿病治疗新药的开发(详见BioArt此前的报道:B型GPCR信号转导机制);上周,来自北卡教堂山分校汪胜博士等人解析了精神分裂症的主要靶点D2多巴胺受体与抗精神病药物利培酮(Risperidone)复合体结构,首次阐释了抗精神病药物的副作用--extrapyramidal symptoms--结构学基础(详见BioArt此前的报道:精神分裂症靶点—多巴胺D2受体结构解析)。
北京时间2月2日,来自上海科技大学iHuman研究所的研究团队联合美国美国北卡莱罗纳大学教堂山分校的研究人员在Cell杂志上发表了题为“5-HT2C Receptor Structures Reveal the Structural Basis of GPCR Polypharmacology”的研究论文,解析了与肥胖、精神类疾病密切相关靶点——五羟色胺2C受体 (human serotonin 2C receptor, 5-HT2C) 的三维精细结构,并以此为线索,揭示了人体细胞信号转导中的“重要成员”——G蛋白偶联受体(GPCR)家族多重药理学的分子机制。值得一提的是,该研究是上海科技大学iHuman研究所继2016年、2017年在国际上首次发表大麻素受体、胰高血糖素样肽受体高分辨率三维结构之后的又一重要突破,是GPCR结构功能研究领域的又一项高水平、系统性的研究成果。

人体细胞表面分布着许多G蛋白偶联受体,其功能相当于细胞的“信号兵”。这些“信号兵”负责细胞间的信息交流,进而广泛参与人体生理或病理状态的调节。它们与人们的日常生活密切相关——比如眼睛能看到灿烂的阳光,鼻子能闻到花朵的芬芳,舌头能尝到食物的酸甜苦辣,其失调将导致疾病的发生。因此,GPCR是药物研发领域的“宠儿”,目前市场上超过40%的在售药物都以GPCR为靶点。GPCR家族成员具有非常保守的七次跨膜螺旋结构,配体与受体结合后,通过跨膜区的构象变化,将信息传递到细胞内。配体的性质决定GPCR的状态:起激活作用的配体(激动剂)使受体活化,而起抑制作用的配体(拮抗剂)则抑制受体活性的发挥,受体与这两类配体结合后呈现的三维结构可以说是这个受体的“动静两面”。针对不同的GPCR,激动剂或拮抗剂配体具有不同的药物开发价值。
作为GPCR家族的一份子,五羟色胺2C受体(5-HT2C)负责调控人体情绪、食欲、睡眠、疼痛、成瘾、记忆等多个重要生理和心理状态。目前已有针对五羟色胺2C受体的药物上市,如氯卡色林就是被美国FDA批准上市的减肥药。五羟色胺2C受体也是抑郁症,精神分裂症,药物成瘾以及其他精神类疾病的潜在药物靶标。
然而,基于五羟色胺2C受体的药物研发并不顺利,很多疗效很好的小分子药物由于脱靶效应导致不同程度的副作用。如减肥药氯卡色林也能作用于其他靶标而导致心脏瓣膜疾病的发生。究其原因,主要是由于五羟色胺受体家族成员间相似度很高,导致药物无法准确识别其作用靶标。这种现象在其它靶向药物中也经常出现,成为药物研发的痛点。
因此,在针对GPCR进行药物设计时需要根据实际情况采取不同策略:一种方案是使药物具备高度选择性,即一种药只作用到一种靶点上(“一石一鸟”),这样有助于避免药物的副作用,这也是传统药物设计所采取的方案;另一种则是使药物具备多重药理性,即一种药物作用到多个需要的靶点上(“一石数鸟”),在巧妙规避产生副作用靶点的同时,提高药物治疗复杂疾病的药效。“一石数鸟”的药物研发策略主要运用在解决复杂疾病上,如受多个靶点调控的精神类疾病等。
有鉴于此,2014年6月,上海科大iHuman研究团队决定以五羟色胺2C受体为研究对象探索多重药理学药物设计的结构基础。在随后的两年半中,研究团队克服重重困难,在尝试了200多个克隆构建、多种蛋白质表达系统及纯化条件、结晶优化及数据收集实验后,最终同时解析了激动剂和拮抗剂结合的两种不同状态的受体结构(下图)。
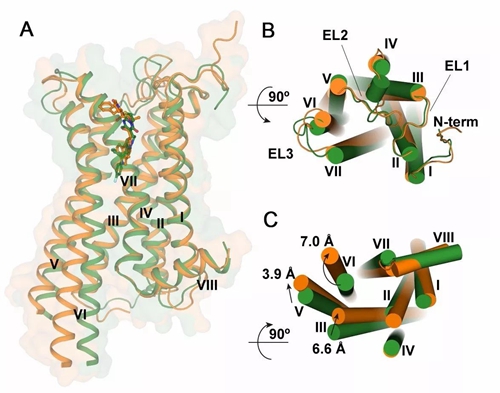
A:两种不同状态的五羟色胺2C受体三维结构图, 橙色为激活状态,绿色为抑制状态。B:细胞膜外的差异 C:细胞膜内的差异
通过获得五羟色胺2C受体与两种不同药物分子相结合的“3D照片”(即精细三维结构),研究者首次在一种GPCR上分别揭示激动剂具有多重药理特性(“一石数鸟”)以及拮抗剂获得高选择性(“一石一鸟”)的分子机制。为针对不同需求设计更加精准的靶向药物提供了理论依据。值得一提的是,这也是在国际上首次获得处于拮抗状态五羟色胺受体的三维结构。
“在人体中有800多个G蛋白偶联受体,但至今只有近50个GPCR的新结构获得解析。在此之前,只有2个五羟色胺受体结构得到解析,并且均是激动态的”。论文第一作者彭瑶说:“在经过不懈努力后最终在同一天获得激动和拮抗两种不同状态的受体结构,有一种梦想成真的感觉。这一对受体结构就好似一个人具有完全不同的双重性格。通过分析和比较两个结构及功能异同,为我们深入研究五羟色胺2C受体与药物分子的相互作用机制提供了极其宝贵的信息。”
“通过分析晶体结构以及两种不同配体的药理学作用,我们提出了针对G蛋白偶联受体结构进行多重药理性药物设计的思路。相信这种尝试对未来药物研发必将有很好的启发意义。” iHuman研究所刘志杰教授说道。“我们对于G蛋白偶联受体多重药理性分子机制的理解仍处于初期,针对复杂的重大疾病进行多重药理学药物设计的过程还有很多难题急需攻克。希望经过研究团队的努力能够促进人们对GPCR多重药理学机制的深入了解,为解除病人病痛设计出更加神奇的多靶点药物,” Ray Stevens教授总结道, “这将为新一代G蛋白偶联受体药物设计描绘出更加清晰的路线图。”
据悉,上海科技大学与中国科学院生物物理研究所联合培养博士生彭瑶为论文第一作者,iHuman研究所执行所长刘志杰教授、创始所长、特聘教授Ray Stevens及美国北卡莱罗纳大学Bryan Roth教授为论文共同通讯作者, 上科大为第一完成单位。本项研究中丹麦哥本哈根大学David E. Gloriam课题组负责结构信息分析工作, iHuman研究所赵素文课题组负责计算生物学,程建军课题组负责药物化学分析工作。iHuman研究所基因克隆平台、真核细胞表达平台、蛋白纯化平台、功能研究平台的工作人员为该项研究提供了强大的技术支持。

上海科技大学iHuman研究所科研团队合影

论文第一作者彭瑶
后记:
作为一个国际化高水平的研究机构,上海科技大学iHuman研究所(ihuman.shanghaitech.edu.cn)聚集了一批从事人体细胞信号转导的国内外知名学者,通过整合多种研究方法,聚焦跨尺度多模态的整合生物学研究。刘志杰教授和Ray Stevens教授领导的研究团队在过去两年中在多个重要GPCR的结构与功能研究中获得突破,他们对大麻素受体CB1的系列研究成果分别发表在2016年10月的《Cell》和2017年7月的《Nature》上,与糖尿病相关靶点GLP1的研究成果发表在2017年5月的《Nature》上。各类科研人才齐聚,加上高水平的科研平台,严谨务实的科研氛围,开放活跃的学术交流气氛使iHuman这个年轻的研究所已初具国际一流研究机构的良好发展态势。
2016年4月15日,国务院发布上海科创中心建设方案,明确指出上科大在上海张江综合性国家科学中心建设中承担重要任务。目前,学校正与中科院上海分院科研院所等单位合作,负责或参与建设软X射线自由电子激光用户装置、活细胞结构和功能成像等线站工程、超强超短激光实验装置、上海光源二期线站工程,牵头硬X射线自由电子激光装置的启动和建设,并承担多项科创中心建设重点工作。截至2018年1月,学校的五个学院、三个研究所(包括iHuman研究所)已经建立了157个研究组,科研工作全面开展,五羟色胺2C受体三维结构解析这样的高水平科研成果正在不断涌现,这些科研突破也正是上海科创中心在基础科学研究方面的重大成果之一。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!





















































 京公网安备 11010802027423号
京公网安备 11010802027423号