Cell丨宋尔卫团队揭示成纤维细胞亚群调控肿瘤干细胞新机制
本文获“BioArt”授权转载,版权归“BioArt”所有,任何转载需获得“BioArt”授权。
“岩”是中医对癌症的描述。我们的祖先很早就认识到“质硬如石”是恶性肿瘤的重要临床特征。但肿瘤细胞本身并不硬,“质硬”是由于肿瘤微环境中成纤维细胞激活分泌胶原所致。因此,成纤维细胞激活是恶性肿瘤的共同特性。早期研究发现成纤维细胞促进肿瘤发生发展,提示其可能是良好的治疗靶点。但近期的临床试验发现,针对成纤维细胞的治疗反而加速癌症病人的病情发展【1】。因此,既往研究提示肿瘤相关成纤维细胞具有高度的异质性【2】。但与其他炎症细胞不同,成纤维细胞缺乏有效分群的表面标记物【3,4】。如何分选和特异靶向不同成纤维细胞亚群成为目前肿瘤微环境研究领域的前沿热点问题。
1月26日,中山大学孙逸仙纪念医院宋尔卫、苏士成团队在Cell杂志在线发表了题为“CD10+GPR77+Cancer-Associated Fibroblasts Promote Cancer Formation and Chemoresistance by Sustaining Cancer Stemness”的研究论文。该研究率先运用细胞膜蛋白CD10和GPR77为化疗耐受相关的成纤维细胞亚群贴上“身份标签”,发现了一种新型表达CD10+与GPR77+细胞表面标记分子的癌症相关成纤维细胞,此种成纤维细胞可显著促进乳腺癌与肺癌病人对化疗的耐药性,并为肿瘤干细胞的干性维持提供了环境。

癌症相关成纤维细胞(Carcinoma-associated fibroblasts,CAFs)在肿瘤形成与癌症治疗靶点的筛选中都起到了重要作用。然而,CAFs具有异质性,并包含了众多表型与功能不一的亚群,有部分研究以CAF胞内细胞因子的表达来界定其亚群分类,但CAFs细胞相关表面分子标记的研究缺乏的阻碍了肿瘤的研究与治疗的应用。
肿瘤干细胞(Cancer stem cells,CSCs)是肿瘤的发生发展与耐药性的关键因素,其所表达的分子标记尚不明确。CSCs特异性的维持需要特殊环境的维持。虽然CAFs是CSCs干性维持环境的重要成员, 然而只有乳腺癌中分离出的CAFs可促进CSCs的聚集,其作用机理并没有解决。
既往关于成纤维细胞数目和病人预后的报道相互矛盾【2】,提示既往的临床模型难以研究肿瘤相关成纤维细胞的异质性。该研究率先采用术前化疗作为研究肿瘤微环境异质性的临床模型。发现未经治疗的术前穿刺标本中,成纤维细胞数目与日后的术前化疗敏感性无关。但是,经过术前化疗后,耐药标本的成纤维细胞数目明显高于敏感标本。同时,耐药标本的分离成纤维细胞能诱导共培养的肿瘤细胞耐药,而敏感标本分离的成纤维细胞则不能。通过对比耐药和敏感标本成纤维细胞的表达谱,该研究利用CD10、GPR77这两个差异表达的膜蛋白,鉴定出一个CD10+GPR77+成纤维细胞亚群。并发现这类型的成纤维细胞数目与乳腺癌及肺癌病人的预后和化疗敏感性相关。该研究首次通过临床标本高通量筛选发现的膜蛋白鉴定成纤维细胞亚群。
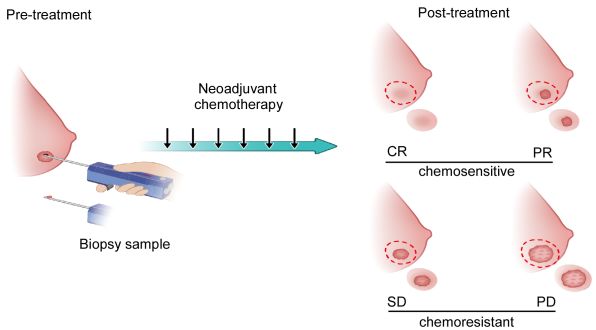
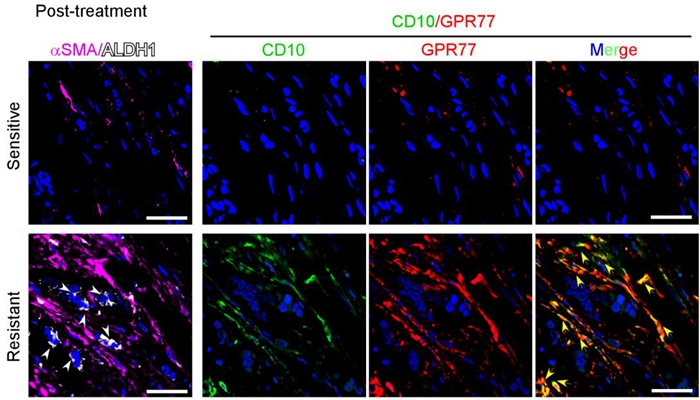
CD10+GPR77+成纤维细胞的密度与乳腺癌患者术前化疗耐受及肿瘤干细胞的富集显著相关
从分子机理角度讲:CD10+GPR77+成纤维细胞亚群通过IL-6与IL-8维持肿瘤干细胞干性,从而导致肿瘤化疗耐药。IL-6和IL-8的分泌由持续激活的NF-kB信号调控。有趣的是,在这群细胞中NF-kB的持续激活不依赖IkB的降解。进一步研究发现,肿瘤微环境中的C5a作用于其受体GPR77,使下游RSK-1磷酸化,进而介导了非IKK依赖的p65 Ser536磷酸化。而该位点的磷酸化是p300介导的p65 lys310乙酰化的基础【5】。p65乙酰化导致p65持续滞留在细胞核内,导致了NF-kB信号的持续激活【6】。该研究首次阐述了补体分子对炎症转录因子转录后修饰的调控作用。
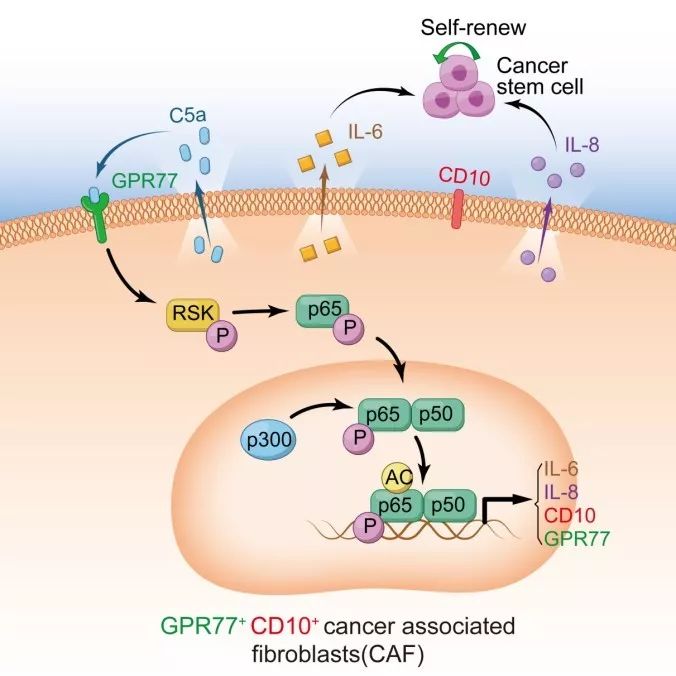
GPR77之前在成纤维细胞中的作用没有报道,那么靶向GPR77是否具有治疗价值?为了最大程度地模拟病人的肿瘤微环境,研究者采用了病人来源异质瘤(PDX)的动物模型。将富含CD10+GPR77+成纤维细胞的人肿瘤标本移植到小鼠脂肪垫,进而使用GPR77的阻断抗体进行治疗。实验结果显示,靶向GPR77减少肿瘤干细胞的数目和增强肿瘤化疗敏感性。因此,该研究为靶向肿瘤干细胞微环境的治疗提供了新思路。
据悉,苏士成、陈嘉宁和姚和瑞为本文共同第一作者,宋尔卫是通讯作者,中山大学是唯一作者单位。宋尔卫、苏士成团队长期致力于肿瘤微环境调控肿瘤细胞可塑性,取得了一系列系统性创新研究成果,其中包括在Cancer Cell、Cell Research、Cancer research 等国际著名期刊发表的多篇代表性论文。
参考文献:
1. Amakye,D., Jagani, Z., and Dorsch, M. (2013). Unraveling the therapeutic potential ofthe Hedgehog pathway in cancer.Nat Med19, 1410-1422.
2. Paulsson,J., and Micke, P. (2014). Prognostic relevance of cancer-associated fibroblastsin human cancer.Semin Cancer Biol25,61-68.
3. Ohlund,D., Handly-Santana, A., Biffi, G., Elyada, E., Almeida, A.S., Ponz-Sarvise, M.,Corbo, V., Oni, T.E., Hearn, S.A., Lee, E.J.,et al. (2017). Distinct populations of inflammatory fibroblasts andmyofibroblasts in pancreatic cancer.J Exp Med214, 579-596.
4. Sugimoto,H., Mundel, T.M., Kieran, M.W., and Kalluri, R. (2006). Identification offibroblast heterogeneity in the tumor microenvironment.Cancer Biol Ther5, 1640-1646.
5. Chen,L.F., and Greene, W.C. (2004). Shaping the nuclear action of NF-kappaB.Nat Rev Mol Cell Biol5, 392-401.
6. Chen,L., Fischle, W., Verdin, E., and Greene, W.C. (2001). Duration of nuclearNF-kappaB action regulated by reversible acetylation.Science293, 1653-1657.
作者简介:

宋尔卫,主任医师,教授,博士生导师,中山大学中山医学院院长,中山大学孙逸仙纪念医院院长;国家杰出青年基金获得者,教育部长江学者特聘教授,国家重大科学研究计划项目首席科学家,国家自然科学基金创新研究群体项目主持人。其所带领的团队主要围绕乳腺癌等恶性肿瘤转移开展研究,在非编码RNA(ncRNA)和肿瘤微环境调控癌细胞可塑性与肿瘤转移领域取得了系统性的创新成果。共计发表SCI论文114篇,SCI他引6400余次。其中通讯作者论文54篇,包括在Cell, CancerCell, NatureMedicine, Nature Biotechnology, Science Tranlational Medicine等国际著名杂志发表的论文,通讯作者论文SCI他引总数3300余次,单篇最高1051次。以第一完成人获2015年国家自然科学二等奖、2013年何梁何利奖等。

苏士成,副主任医师,副研究员,博士生导师,中山大学孙逸仙纪念医院乳腺肿瘤医学部副主任,中山大学树华乳腺癌研究中心主任。国自然优秀青年基金获得者,教育部长江青年学者,国家重点研发项目青年专项首席专家。主要研究方向是肿瘤微环境促进乳腺癌转移耐药机制和免疫治疗的临床转化应用。以通讯/第一作者发表SCI论文11篇,包括Cell, CancerCell, Nature Communication(2), Cell Research, Cancer Research, Oncoimmunology等。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号