多环蒽醇类天然产物的绿色高效合成方法
蒽醇蒽醌类的多环化合物广泛存在于天然产物以及活性药物分子中(图1)。其中,最为著名当属抗肿瘤抗生素阿霉素(doxorubicin)以及抗菌抗生素四环素(tetracycline);此外,从紫草科(Boraginaceae)植物中分离出的Oncocalyxone B,具有镇痛、抗炎、抗氧化抑制血小板激活等活性;侧耳属菌种中分离出的Pleurotin,对革兰氏阳性菌具有较好的抑制活性(如金黄色葡萄球菌),同时也对多种癌症细胞(乳腺癌和结肠癌等)有较好的抑制作用。这些活性天然产物均具有蒽醇蒽醌类骨架,而立体选择性的构建含一个或连续季碳中心的多环蒽醇化合物一直是有机合成领域的难点。
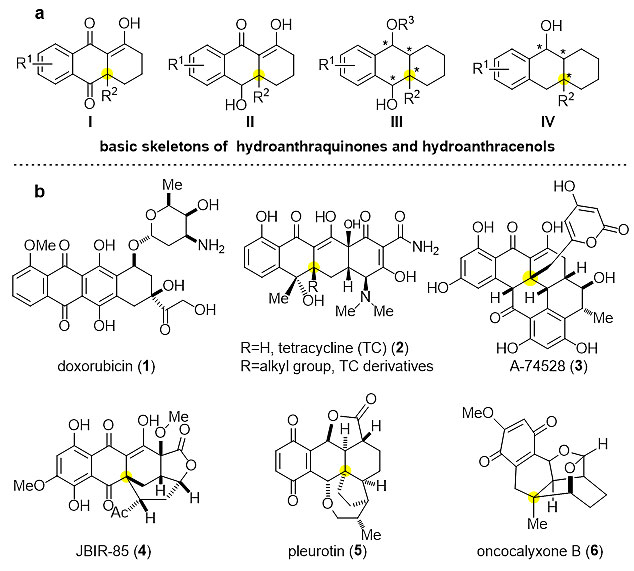
图1. 含有蒽醇或蒽醌类骨架的天然产物
华东师范大学化学与分子工程学院高栓虎教授(点击查看介绍)团队一直致力于活性天然产物的全合成研究,围绕天然产物合成领域的关键科学问题,针对具有多并环结构的复杂天然产物的全合成,探索和发展了高效的合成方法和策略,包括:光催化反应;串联加成反应,仿生环化反应等。该团队报道了紫外光催化电环化反应(Photo-Nazarov)(Chem.-Eur. J., 2014, 20, 8677-8681.),实现了含有季碳中心的氢化芴酮核心骨架构建,并将其用于萜类天然产物taiwaniaquinol B,石蒜科类生物碱gracilamine的全合成(Angew. Chem. Int. Ed., 2014, 53, 9539-9543)。
近期,该团队针对光促进的烯醇化photoenolization Diels–Alder(PEDA)反应进行了深入研究,解决了传统PEDA反应中存在大位阻的双烯与亲双烯无法有效反应的难题,成功实现了一系列含有全碳季碳中心的氢化蒽酚并环结构的高效构建。与传统的构建蒽醇蒽醌类化合物的方法(Hauser环化和Staunton/Weinreb环化,图2)相比,此反应具有条件温和,高立体选择性等优点,可以利用大位阻的底物绿色高效的合成多种含有连续手性中心的多环化合物。
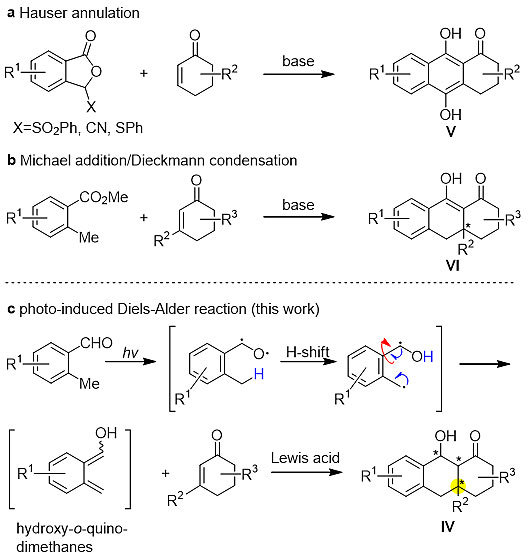
图2. 构建蒽醇结构的方法
起初,作者利用大位阻环状的亲双烯体3-甲基环己烯酮对传统PEDA反应进行各种溶剂的考察,并不能有效地获得目标产物。通过对一系列条件的摸索,作者发现Lewis酸,钛酸四异丙酯的加入能够很好的促进该反应,实现大位阻亲双烯体的活化,经过条件优化,最终能够以优秀的转化率良好的分离产率获得具有全碳季碳中心的多并环目标产物,并以单晶确定其相对构型。同时对照实验表明紫外光以及Lewis酸都至关重要,两者缺一不可(图3)。
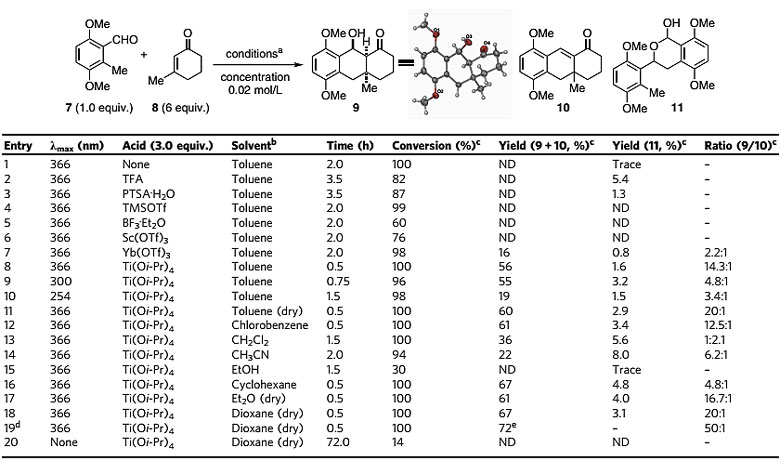
图3. 反应条件的筛选
在获得最佳反应条件后,作者对PEDA反应的底物适用范围进行了广泛的考察。大位阻单环的3-甲基环己烯酮衍生物都能取得很好的反应效果,其中对酸敏感的4-位OTBS取代的底物同样具有良好的兼容性。空间位阻更大的双并环亲双烯体,特别是Hajos-Parrish ketone以及Wielend-Mischer ketone结构中烯酮3-位处在桥头碳上,在最优条件下都能以中等收率取得目标四环化合物,甚至结构上更为复杂,空间上位阻更大的甾体类烯酮化合物也能很好的发生反应(图4)。
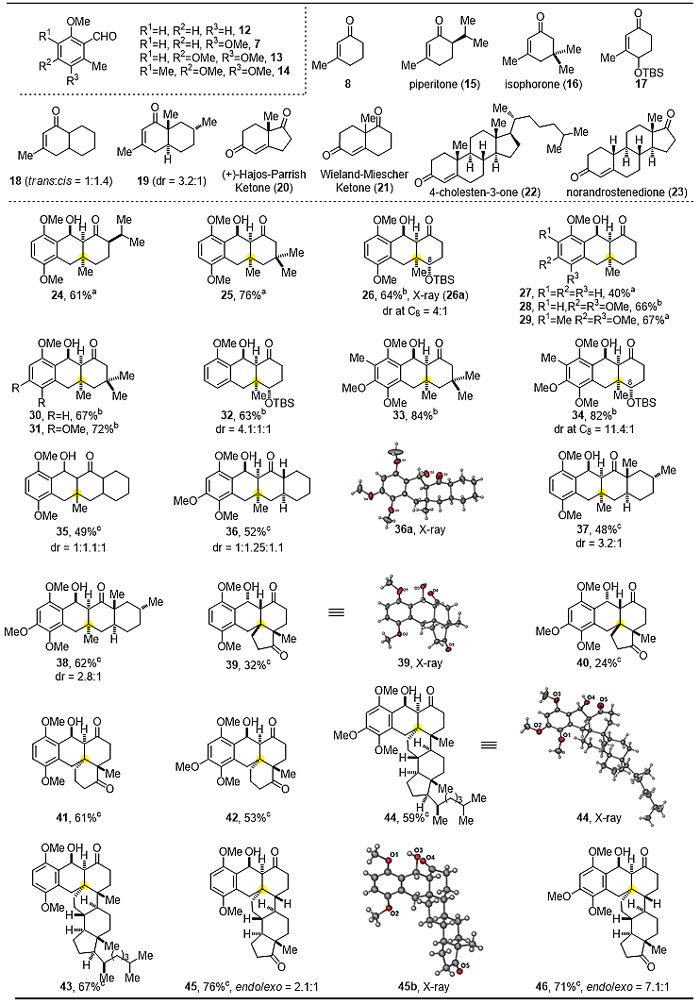
图4. PEDA反应底物普适性考察一(亲双烯体为β位有取代的环己烯酮衍生物)
在3-位有取代的单环、双环、多并环的环己烯酮衍生物考察完后,作者也对2-位有取代的环状和非环状烯酮底物进行较为深入的考察(图5),发现各种环状或链状的醛、酮、酯都能较好的兼容,并且都可以取得较好的收率,产物相对构型通过单晶衍射确定。

图5. PEDA反应底物普适性考察二(亲双烯体为1,1-二取代烯烃衍生物)
此外,作者选取位阻更大的1,1,2,2-四取代的烯烃作为亲双烯体,从而一步构建连续的全碳季碳中心,亲双烯体上吸电子基团对构建连续季碳中心影响比较大,醛和酮都能较好的发生反应,和三取代双键的反应效果相差不大,但当吸电子基团是酯基时,由于活性较弱不能发生反应,如图6所示。
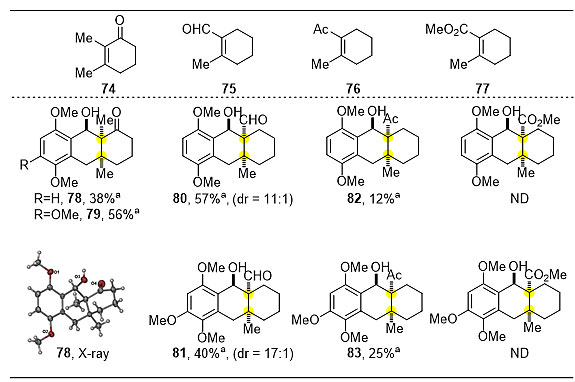
图6. PEDA反应底物普适性考察三(亲双烯体为1,1,2,2-四取代烯烃衍生物)
应用该反应,高栓虎团队完成了天然产物Oncocalyxone B的全合成。Oncocalyxone B 是cordiachrome家族天然产物中较为复杂的一个,含有蒽醇的基本骨架,拥有五个连续的手性中心且在C-8a位有一个季碳中心,同时有一个笼状的缩醛结构。如图7所示,三甲氧基取代的邻甲基苯甲醛13和4-位带有OTBS的3-甲基环己烯酮发生钛酸四异丙酯促进的PEDA反应,生成多立体中心的氢化蒽醇骨架88,单晶衍射显示其C-8位羟基构型与天然产物相反,首先对C-8位构型进行翻转,MOM保护,Tebbe反应对羰基亚甲基化,TBAF脱掉TBS保护,氧化还原即可实现C-8位构型的翻转。化合物91在二氯甲烷中经苄位碳正离子中间体自发的形成带氧桥的化合物92, 硼氢化氧化端烯得到α-醛化合物93,碱性条件下构型翻转成β-醛94,再在四氯化锡催化下发生串联的氧桥环开环缩醛化反应,得到化合物95,最后CAN氧化,从而完成目标分子Oncocalyxone B的合成。

图7. PEDA反应在天然产物Oncocalyxone B全合成中的应用
这一成果近期发表在Nature Communications 上,华东师范大学在读博士生杨鲍潮为该论文第一作者,此外课题组在读硕士生林快快和博士后史英博对该研究成果做出了重要贡献。
该论文作者为:Baochao Yang, Kuaikuai Lin, Yingbo, Shi, Shuanhu Gao
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Ti(Oi-Pr)4-promoted photoenolization Diels–Alder reaction to construct polycyclic rings and its synthetic applications
Nat. Commun., 2017, 8, 622, DOI: 10.1038/s41467-017-00440-8
导师介绍
高栓虎
http://www.x-mol.com/university/faculty/10566
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号