基因改造的类脂质体纳米载药系统研究进展
2017年12月27日,国际知名期刊Advanced Materials 在线发表了厦门大学刘刚教授(点击查看介绍)课题组研究论文:《Genetically engineered liposome-like nanovesicles as active targeted transport platform》。
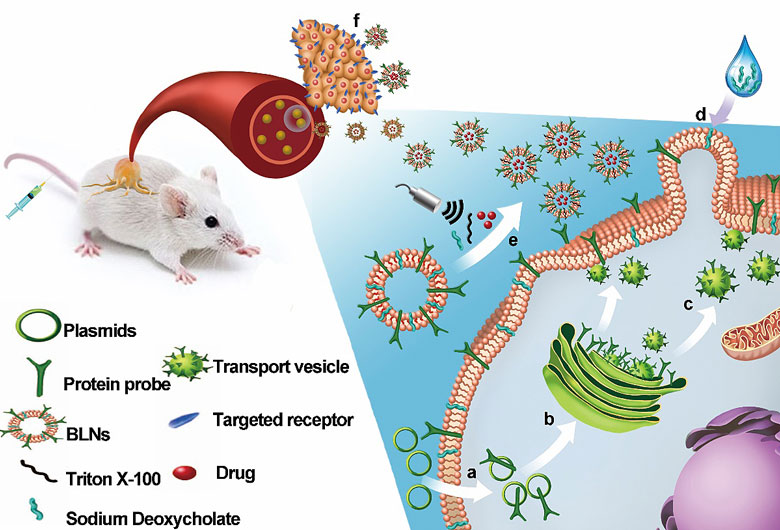
在精准医学领域,如何将药物主动靶向投递到各种类型的肿瘤细胞群体以及避免传统化学非特异性共价偶联方法对靶向蛋白配体的生物活性的损害仍然存在巨大的挑战。受到机体内的外泌体作为天然的物质运输载体的启发,刘刚教授课题组成功制备出了一种表面可以展示多种靶向蛋白配体的类脂质体纳米囊泡(PNAS, 2015; Nano Today, 2017),并用作蛋白质药物递送平台,该平台可以通过基因工程的手段在生物细胞膜的表面上高效展示各种功能蛋白(例如:细胞因子、单链抗体、纳米抗体以及亲合体等),改善了蛋白药物的稳定性、生物利用度及疗效(授权专利号: CN201510622004.8)。
在本项研究中,该课题组进一步通过在类脂质体纳米囊泡上分别展示了抗EGFR的表皮生长因子和抗HER2受体的亲合体作为靶向蛋白,实现了分别靶向两种不同亚型的乳腺癌小鼠模型(MDA-MB-468和BT474乳腺癌模型)。与课题设计预期一致的是,该纳米囊泡上通过生物展示的基因工程改造后的表皮生长因子配体,其生物活性和靶向能力明显优于通过化学共价偶联于脂质体的表皮生长因子。此外,展示亲合体的纳米囊泡显示出了比临床使用的脂质体化的阿霉素更好的肿瘤特异性累积效果和治疗结果。上述系列研究都证明了该生物功能化的纳米囊泡具有靶向运输药物到各种类型的肿瘤细胞群体以及机体其他功能细胞(如免疫细胞、胰岛细胞和肝脏细胞等)的巨大潜力,有希望作为传统的蛋白脂质体和免疫脂质体的有效替代物,从而形成一种新型的诊疗一体化的纳米药物投递平台,开辟了药物靶向投递领域的新方向。
厦门大学刘刚教授为上述论文的通讯作者,其课题组主要从事多功能分子影像探针的可控设计、构建及医学应用评价研究工作。自2012年入职厦大以来,刘刚教授以通讯或共同通讯作者身份在国际知名杂志发表SCI论文50余篇(NS子刊及影响因子10分以上的论文14篇,PNAS 等7-10分的论文20余篇)。此外,参编World Scientific、Elsevier、Springer及Wiley出版社发行的英文专著8部并申报中国发明专利10余项(已授权4项)。上述系列研究工作得到了国家自然科学基金委优秀青年基金等项目的支持。
该论文作者为:Pengfei Zhang, Long Zhang, Zainen Qin, Suhang Hua, Zhide Guo, Chengchao Chu, Huirong Lin, Yang Zhang, Wengang Li, Xianzhong Zhang, Xiaoyuan Chen, Gang Liu
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Genetically Engineered Liposome-like Nanovesicles as Active Targeted Transport Platform
Adv. Mater., 2017, DOI: 10.1002/adma.201705350
导师介绍
刘刚
http://www.x-mol.com/university/faculty/39458
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号