亲核氟化反应的研究进展
近年来对有机氟化学的研究越来越受到有机化学家的重视,其主要的驱动力是有机氟化物在医药[1]、农药[2]及材料[3]等领域显示出了越来越广泛的应用。氟是自然界中电负性最大的元素,而其原子半径又与氢原子最接近[4,5]。因此,在药物设计中经常利用氟原子及含氟取代基的电子效应、阻碍效应、伪拟效应、渗透效应等设计和改造药物。研究发现,在药物分子中引入氟原子,常常可以增强药物的结合力、改变理化性质、提高药物的代谢稳定性和选择性,从而提高药效[6]。
由于有机氟化合物具有广泛的应用价值,因此如何获得有机氟化合物就显得非常重要。然而,自然界提供的有机氟化合物非常少,目前从天然产物中获得的有机氟化合物只有12个[7],因此大量所需的有机氟化合物只能通过人工合成来得到。
目前,向有机分子中直接引入氟原子的方法主要有亲电氟化和亲核氟化[8]。其中,亲电氟化已被广泛应用于氟化反应,主要得益于近年来高效亲电氟化试剂的出现,如DesMarteau试剂[9]、全氟呱啶[10]、Umist试剂[11]、Umemoto试剂[12]、NF-TEDA试剂(Selectfluor)[13]等。由于这些亲电氟化试剂的出现,使得亲电氟化得到了迅速发展,但大部分亲电氟化试剂都比较昂贵、不利于大规模工业应用。而亲核氟化发展缓慢,主要原因是氟本身较强的电负性,使C-F键的形成需要较高的能量。其次是氟化物易形成氢键,这导致了氟化试剂的亲核性减弱,同时大大增强了其碱性,从而引起了副反应消除[14]。
基于亲核氟化试剂(如NaF、KF)非常便宜,且工业易得等这样的优点,一直以来人们都在研究用它作氟源向有机分子中入氟原子,并取得了一定进展。本文主要以亲核氟化试剂种类,来介绍近年来的亲核氟化的发展。
1 HF类型参与的氟化反应
氢氟酸作为许多氟化物的前体化合物,是一种非常有用的基本物质,但它本身是一种非常有害的试剂,又有极强的腐蚀性,因此为了更安全更方便地处理和使用氟化氢,化学家们通过各种方法已经发展了许多HF类的试剂。主要有两大类为胺-HF和醚-HF。
自1973年Olah等人合成了聚氢氟酸吡啶盐以来[15],后续发展了Yarovenko`s试剂[16]、TREAT-HF(Scheme 1)[17]。
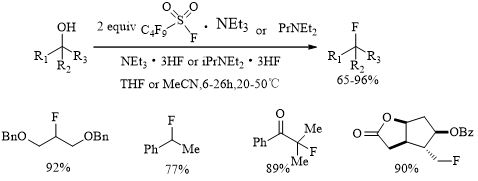
Scheme 1 TREAT-HF参与的亲核氟化反应
随着金属有机化学的兴起,出现了金属络合物与HF试剂同时进行的氟化反应,如Ir-TEA·3HF(Scheme 2)[18]。

Scheme 2 Ir-TEA·3HF参与的亲核氟化反应
本实验过程采用金属Ir的络合物进行的烯丙基式氟化反应,反应条件温和,并有很高的产率且有良好的区域选择性。随后Huw M. L. Davies在2013年报道了采用AgOAc与Et3N·3HF进行的亲核氟化反应(Scheme 3)[19]等。
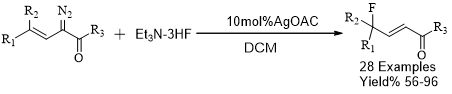
Scheme 3 Ag-Et3N·3HF参与的亲核氟化反应
该反应为合成含氟α,β-不饱和羰基合成子提高了温和的方法。同时,为合成PET提供了一种高效的合成策略。虽然这两种方法均为亲核氟化反应提供了方法,但金属参与的反应不便于实际生产的推广,以及贵金属易流失,使得产品携带有重金属离子。
近年来,随着高碘化合物在有机合成中得到广泛的应用,高碘试剂具有温和的氧化性,化学性质类似于过渡金属及易离去性等特点[20]。基于以上特点,科学家发展了TEA·5HF与Ar2IO同时参与亲核氟化反应[21](Scheme 4)。

Scheme 4 TEA·5HF与Ar2IO同时参与的亲核氟化反应
2胺基氟化硫类型参与的氟化反应
二烷基三氟化硫化合物最早是由Demitras小组在1964年首次合成[22]。到了20世纪70年代,Markovskii[23]和Middleton[24]制备了一系列二烷基三氟化硫化合物并进行了相关氟化反应的研究。由于前期发展的胺基氟化硫试剂易分解,高温易爆炸,随后合成了一系列不易爆炸、易结晶、对水不敏感的试剂,如XtalFlour-E试剂及相关试剂[25,26](Scheme 5)。
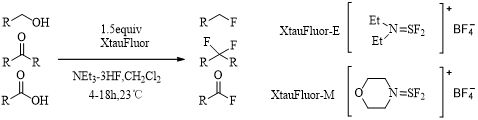
Scheme 5 XtalFlour-E参与的亲核氟化反应
3TBAF参与的氟化反应
TBAF是一种商业易得,易溶于有机溶剂的亲核试剂。TBAF主要参与的反应是氟取代反应。如Stephen G. DiMagno在2005年报道的无水氟化四丁基铵[27](Scheme 6)。
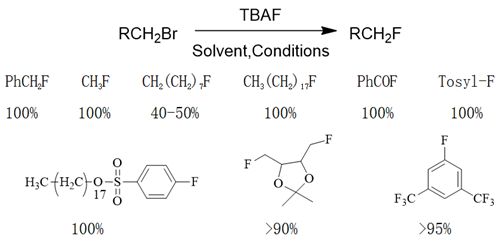
Scheme 6 无水TBAF参与的亲核氟化反应
随后,在2008年Dong Wook Kim报道采用TBAF与叔丁醇协同的的氟化反应[28](Scheme 7)。
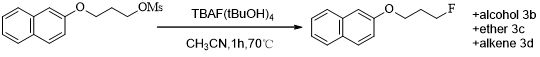
Scheme 7 TBAF与叔丁醇协同的的氟化反应
氟化四丁基铵与叔丁醇形成一个独特的和稳定的结构,TBAF被四个空间位阻大的且非极性质子化的叔丁醇分子包裹,形成一个“灵活”的氟形式。同时,在无水状态的反应条件下,低吸湿性,以及良好的亲核性低碱度。这些有利的性质抑制副反应(羟基、烷氧基化和消除等)使氟化反应更容易处理。
除了季铵盐氟化物参与的氟取代反应,还有Pd-TBAF参与的烯丙基氟化反应[29](Scheme 8)。
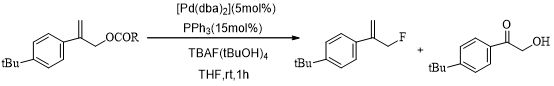
Scheme 8 Pd-TBAF参与的烯丙基氟化反应
总之,该方法介绍了钯催化下C-F键的形成方法。通常卤化物不适于进行过渡金属试剂催化的烯丙基取代。但该方法的提出,扩大该反应的范围,使其更具挑战性。同时,反应可以在较低的温度下进行,克服了传统的亲核取代温度高的缺点,而且可以应用于含有供电子基团的底物,这对亲核取代氟化反应是一重大的突破。
4碱金属氟化物参与的氟化反应
碱金属氟化物作为传统的氟源,与上述的三种类型的亲核氟化试剂相比,其使用方便且易取,成本低,但使其在有机反应应用的限制是由于其在难溶于有机溶剂,并导致亲核性减弱。尽管存在着这样的缺点,但仍取得了不错的成绩。
Dae Yoon Chi分别在2002年报道在离子液体中利用KF作为氟源进行的亲核氟反应[30](Scheme 9)。
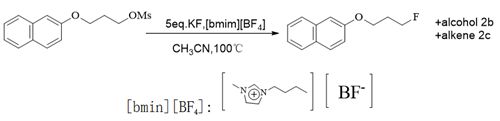
Scheme 9 KF作为氟源进行的亲核氟反应
该方法采用KF与离子液体协同进行氟化反应,离子液体参与使得KF的氟化反应活性大大提高并且使得副产物的产率减少。在2006年报道在叔戊醇条件下CsF为氟源进行的亲核氟反应。该氟化过程采用碱金属氟化物与非质子性溶剂(叔戊醇)协同参与的SN2类型的氟化反应。同时,相比较使用离子液体协同参与的氟化反应,该反应的氟化条件温和,反应时间较快,产物产率较高且副产物较少[31]。
在利用不同溶剂提高碱金属氟化物的氟化能力,同时,化学家们利用冠醚-MF[32]、液态MF[33]等进行的氟化反应,这种方式也为碱金属氟化物参与氟化反应提出了新的方向。因此,利用便宜易得的金属氟化物与高聚的醇类化合物相互作用的亲核氟化反应。如Dae Yoon Chi小组分别在2008年报道利用叔丁醇与CsF形成氢键释放F-[34](Scheme 10-1)。
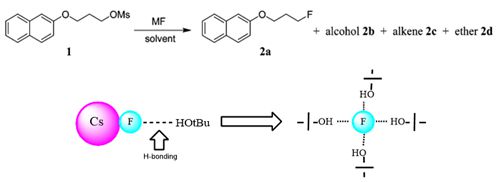
Scheme 10-1 叔丁醇与CsF形成氢键参与的亲核氟化反应
2009年报道利用聚合CsF和KF形成冠醚的形式[35](Scheme 10-2)。

Scheme 10-2 CsF和KF聚合形式参与的亲核氟化反应
2010年报道利用PSpentaEG和CsF作为氟化条件[36](Sheme 10-3)。
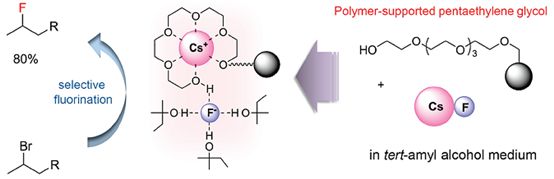
Scheme 10-3 PSpentaEG和CsF作为氟化条件
综上以上三种氟化的方法,采用聚合物与碱金属氟化物形成氢键,从而减弱了碱金属氟化物的碱性,增强了F-离子的亲核性[34]。同时,也提高了碱金属氟化物的利用。但其反应条件要求苛刻,参与氟化反应类型及底物类型单一。
5总结
尽管亲核氟化存在着使用高毒性试剂、反应不可控性、反应条件苛刻等不利因素,但随着新型亲核氟化试剂的开发,亲核氟化已取得不错的进展。目前,如何向有机分子中高效地引入氟原子以及不对称氟化反应,依旧是亲核氟化反应的发展方向。
参考文献:
[1] H. J. Bohn,; D. Banner,;S. Bendels,;etal. ChemBioChem. 2004, 5, 637-643.
[2] a) P. Jeschke, ChemBioChem. 2004, 5, 570-589.
b) P. Maienfisch, R. G. Hall, Chimia. 2004, 58,93-99.
[3] a) F. Guittard, E. T. de Givenchy, S. Geribaldi, A. Cambo. J. Fluorine. Chem. 1990, 100, 85-96.
b)F. Babudri, G. M. Farinola, etal. Chem. Commun. 2007, 1003-1022.
[4] D. O’Hagan, Chem,Soc. Rev. 2008, 37. 308-319.
[5] D. Peters; J. Chem. Phys, 1963, 38. 561-563.
[6] a) Hagmann, W. K. J. Med. Chem. 2008, 51. 4359
b) Kirk, K. L. Curr. Top. Med. Chem. 2006, 6,1445
[7] O`Hagan, D.;Harper,D. B. J. Fluorine Chem. 1999, 100. 127
[8] Kirk, K. L. OrganieProeessReseareh&DeveloPmeni. 2008. 12. 305-321
[9] a) Sigh,S.; Des Marteau,D. D.; Zuberc,s. s.;witz, M.;Huang, H-N. J. Am. Chem. Soc. 1987. 109. 7194.;
b) DesMarteau,D. D.; U. S. Pat. 4. 697011, 1987-09-29.;
c) DesMarteau,D. D.; witz. M.; J. Fluorine. Chem. 1991. 52. 7.;
d) Barnette. W. E. J. Am. Chem. Soc. 1984. 106. 452;
e) Lee, S. H. Schwartz, J. J. Am. Chem. Soc. 1986. 108. 2445;
f) Stavber,s. Zupan,M. Synlett1966. 693;
g) Takeuchi. Y.; Suzuki. T. etal. J. Org. Chem. 1999. 64. 5708.
[10] a) Simons, T. C.; Hottman. F. W. etal. J. Am. Chem. Soc. 1957. 79. 3429.
b) Banks, R. E.; Ginsberg. A. E. Haszeldine,R. N. J. Am. Chem. Soc. 1967. 1740
c) Banks,R. E. Tsiliopoulos, E. J. Fluorine Chem. 1986. 34. 261
[11] a) Purrington,S. T.; Jones. W. A. J. Org. Chem. 1983. 48. 761
b) Purrington,S. T.; Jones. W. A. J. Fluorine Chem. 1984. 26. 43
c) Banks,R. E.; Du Boisson,R. A. Tsiliopoulos, E. J. Fluorine. Chem. 1986. 32. 461
[12] a) Umemto. T.; Tomita, K. Tetrahedron Lett. 1986. 27. 3271
b) Umemto. T.; Kawada, K.; Tomita. K. Tetrahedron Lett. 1986. 27. 4465
c) Banks,R. E.; Resheesh, M. K.; Khattaf,S. N. J. Fluorire. Chem. 1991. 54. 207
d) Banks,R. E.; Mohialdin-Khaffaf,S. N. etal. Chem. Commun. 1992. 595
[13] a) Banks,R. E.; Besheesh. M. K.; Mohialdin-Khaffaf,S. N. etal. J. Chem. Soc. Perkin. Trans11996. 2069;
b) Banks, R. E.; J. Fluorine. Chem. 1996. 78. 43
[14] T. Ritter etal. Angew. Chem. Int. Ed. 2013. 52. 8214-8264
[15] Olah,G. A. :Nojima,M. :Kerekes,l. Synthesis 1973, 779-780
[16] N. N. Yarovenko, M. A. Raksha. Zh. Obshch. Khim. 1959. 29 2159-2163
[17] J. J. Yin. D. S. Zarkowsky. D. W. Thomas, M. M. Zhao. M. A. Huffman. Org. Lett. 2004. 6,1465-1468
[18] Jospeh. J. Topczewski,Timothy J. Tewson, HienM. Nguyen, J. Am. Chem. Soc. 2011. 133. 19318-19321
[19] Changming Qin, Huw. M. L. Davies, Org. Lett. 2013. 15. 6152-6159
[20] a) Zhadankin, V. V. J. Org. Chem. 2011. 76. 1185-1197;
b) Merritt, E. A. Synthesis 2011. 517-538
[21] T. Kitamura. J. Org. Chem. 2014. 79. 5842-5846.
[22] a) Demitras,G. C.; kent,R. A.; Mac Diarmid,A. G. Chem. Ind. (London) 1964, 1712
b) Demitras,G. C.; MacDiarmid,A. G. Inorg. Chem. 1967. 6. 1093
[23] a) Markouskii,L. N.; Pashinnik. V. E.; Kirsanov,A. V. Synthesis 1973. 787.
b) Markouskii,L. N.; Pashinnik. V. E.; Kirsanov,A. V. Synthesis 1975. 801.
[24] Middleton,W. J. J. Org. Chem. 1975. 40. 574.
[25] F. Beaulieu, L-D. Beauregard,G. etal. Org. Lett. 2009. 11. 5050-5053
[26] A. L’Heureux. F. Beaulieu,etal. J. Org. Chem. 2010. 75. 3401-3411
[27] Haoran Sun,Stephen G. DiMagno. J. Am. Chem. Soc. 2005. 127. 2050-2051
[28] DongWookKim, Hwan-Jeong Jeong etal. Angew. Chem. Int. Ed. 2008. 47. 8404-8406
[29] JohnM. Brown, Veronique. Gouverneu. etal. Angew. Chem. me. Ind. 2011. 50,2613.
[30] Dae Yoon. Chi. etal. J. Am. Chem. Soc. 2002. 124. 10278-10279.
[31] Dae Yoon. Chi. etal. J. Am. Chem. Soc. 2006. 128. 16394-16397.
[32] Gokel. G. W. In Grown Ethers and CryPtands Royal Society of Chemisty:Carmbrige, 1991
[33] Kim,D. W. Song. C. E. Chi. D. Y. J. Am. Chem. Soc. 2002. 124. 10278-10279.
[34] Dae Yoon Chi etal. J. Org. Chem. 2008. 957-962
[35] Dae Yoon Chi, Choog Eai Song etal. Angew. Chem. Int. Ed. 2009. 48. 7683-7686
[36] Dae Yoon Chi. Dong Wook. Kim etal. Org. Lett. 2010. 12. 3740-3743.
(作者:Lucy Marx)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号